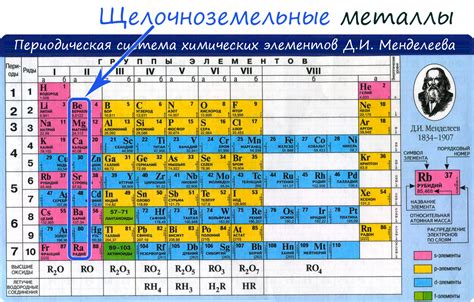
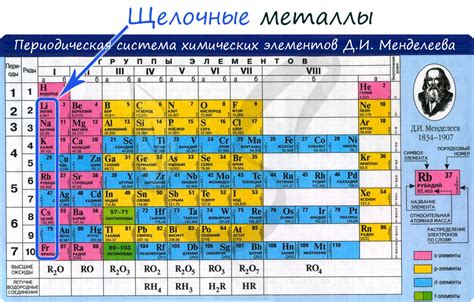
Щелочные металлы - это элементы, которые относятся к первой группе периодической системы и включают лишь несколько металлов: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Химические свойства этих металлов обусловлены наличием всего одного электрона в внешней электронной оболочке, что делает их наиболее активными металлами в периодической системе.
Взаимодействие щелочных металлов с водой является одной из наиболее известных химических реакций, связанных с этими элементами. При контакте с водой щелочные металлы образуют щелочи, проявляющие щелочные свойства. В результате этой реакции металлы выделяются в виде искр, а избыток водорода ускоряет горение, что придает этой реакции яркостью и возможностью использования ее в практических целях.
Щелочные металлы обладают высокой реакционной способностью и способны реагировать с большинством элементов. Например, они сильно реагируют с кислородом, образуя оксиды. В этой реакции металлы окисляются, отдавая электроны, а кислород восстанавливается. Способность щелочных металлов реагировать с кислородом делает их широко используемыми в синтезе и выработке различных веществ.
Взаимодействие щелочных металлов с неметаллическими элементами тоже происходит с выделением большого количества тепла. Например, реакция щелочных металлов с халогенами (фтором, хлором, бромом, йодом) протекает взрывообразно, образуя соответствующие соли и выделяя большое количество энергии, что делает эту реакцию опасной и непригодной для безопасного проведения.
Щелочные металлы и их свойства

Щелочные металлы – это группа химических элементов, которые принадлежат первой группе периодической таблицы. В данную группу входят элементы литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
У щелочных металлов есть несколько характерных свойств. Во-первых, они являются очень реактивными исходными веществами. Это обусловлено их низкой электроотрицательностью, что делает их склонными к образованию положительных ионов и взаимодействию с другими элементами.
Во-вторых, щелочные металлы обладают высокой электропроводностью. Они являются хорошими проводниками электрического тока и тепла.
Также щелочные металлы хорошо растворяются в воде, образуя щелочные гидроксиды. При взаимодействии с водой они выделяютсяиятся водородный газ и образуютщелочные растворы с щелочной реакцией.
Некоторые щелочные металлы обладают способностью окрашивать пламя. Так, калий пригоревает фиолетовым пламенем, рубидий - красным, цезий - голубым. Это связано с высвечиванием характерного спектра света при различных химических реакциях.
Щелочные металлы широко используются в различных областях, включая производство стекла, лекарства, батареи, а также в ядерной энергетике.
Вода и щелочные металлы
Щелочные металлы – это элементы первой группы периодической таблицы, включающие литий, натрий, калий, рубидий, цезий и франций. Они характеризуются высокой реактивностью, особенно в водных растворах. Взаимодействие щелочных металлов с водой имеет свои особенности и приводит к образованию гидроксидов и выделению водорода.
Реакция щелочных металлов с водой является экзотермической и сопровождается выделением тепла. Например, когда мелкий кусочек натрия погружается в воду, происходит оживленное выделение пузырьков водорода, а сам металл растворяется с образованием щелочного раствора. Этот процесс иллюстрирует высокую активность щелочных металлов и их способность реагировать с водой.
Скорость реакции щелочных металлов с водой зависит от некоторых факторов, включая размер металлического образца и его поверхность, температуру воды и концентрацию раствора. Щелочные металлы, такие как литий и натрий, реагируют намного быстрее, чем калий или рубидий. Реактивность также увеличивается с увеличением атомного радиуса элемента, поскольку это позволяет делокализованным электронам металла эффективнее участвовать в реакции.
Реакция щелочных металлов с водой может быть опасной и требует соблюдения осторожности. Взаимодействие металлов с водой может привести к образованию самовозгораемых газов, вызывать взрывы или пожары, а также вызывать ожоги на коже и раздражение слизистых оболочек. Поэтому при работе с щелочными металлами необходимо соблюдать правила безопасности и использовать специальные средства индивидуальной защиты.
Вывод: взаимодействие щелочных металлов с водой характеризуется высокой реактивностью и приводит к образованию гидроксидов и выделению водорода. Данная реакция требует соблюдения осторожности и правил безопасности при работе с щелочными металлами.
Щелочные металлы и воздух

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, являются очень реактивными элементами и обладают способностью взаимодействовать с различными веществами. Воздух также является одним из веществ, с которыми могут взаимодействовать щелочные металлы.
Взаимодействие щелочных металлов с воздухом может привести к образованию оксидов или пероксидов. Например, когда натрий или калий взаимодействуют с воздухом, образуется оксид натрия или оксид калия соответственно.
Эти оксиды обладают различными свойствами и могут быть использованы в различных отраслях промышленности. Например, оксид натрия широко используется в производстве стекла и керамики, а оксид калия может применяться в химической промышленности.
Помимо образования оксидов, щелочные металлы также могут взаимодействовать с кислородом из воздуха и образовывать пероксиды. Например, литий способен образовывать пероксид лития при взаимодействии с воздухом.
Важно отметить, что взаимодействие щелочных металлов с воздухом может привести к образованию пожароопасных соединений, поэтому необходимы предосторожности при работе с этими элементами в окружающей среде.
Щелочные металлы и кислород
Щелочные металлы представляют собой группу химических элементов, которые относятся к первой группе периодической системы. Эти металлы характеризуются высокой реактивностью из-за низкой энергии ионизации и большой тенденции к донорству электронов.
Одним из интересных свойств щелочных металлов является их взаимодействие с кислородом. Когда щелочный металл вступает в контакт с кислородом, происходит реакция окисления. В результате этой реакции образуется соответствующий оксид металла. Взаимодействие щелочных металлов с кислородом происходит с выделением большого количества тепла, что объясняет их высокую реактивность.
Оксиды щелочных металлов обладают особенностями, которые делают их полезными в различных областях. Например, оксид лития (Li2O) используется в производстве литиевых аккумуляторов, а оксид калия (K2O) применяется в сельском хозяйстве как удобрение.
Взаимодействие щелочных металлов с кислородом имеет и практический интерес. Например, натрий реагирует с кислородом при нагревании, образуя оксид натрия (Na2O). Эта реакция широко используется в производстве стекла. Также, реакция калия с кислородом позволяет получить оксид калия (K2O), который используется в производстве мыла и других химических веществ.
Взаимодействие щелочных металлов с неметаллами

Щелочные металлы из группы I периодической системы взаимодействуют с неметаллами, образуя различные соединения. Это происходит за счет активности их внешнего электронного слоя и способности отдавать электроны при реакциях.
Натрий (Na), реагируя с хлором (Cl), образует хлорид натрия (NaCl) – соль, являющуюся основным продуктом реакции. Данное взаимодействие иллюстрирует типичную реакцию щелочного металла с неметаллом, в результате которой образуется ионное соединение с общей формулой MX, где М - металл, а Х - неметалл.
Еще одним примером взаимодействия щелочных металлов с неметаллами является реакция калия (K) с кислородом (O), в результате которой образуется оксид калия (K2O) – соединение, имеющее сетчатую структуру. В подобных реакциях щелочные металлы обычно обладают высокими окислительными свойствами, отдавая электроны неметаллу.
Взаимодействие щелочных металлов с неметаллами также может привести к образованию других соединений, например, галогенидов (соединений с галогенами, такими как фтор, хлор, бром и йод). В таких реакциях щелочные металлы обычно образуют ионы с положительным зарядом, которые связываются с анионами неметаллов.
Подводя итог, взаимодействие щелочных металлов с неметаллами является ключевым аспектом их химических свойств. Это взаимодействие позволяет им образовывать различные ионные соединения с неметаллами, что является основой для многих химических реакций и применений в различных отраслях науки и промышленности.
Щелочные металлы и галогены

Щелочные металлы, такие как литий, натрий, калий и др., обладают особыми свойствами при взаимодействии с галогенами - фтором, хлором, бромом и йодом. Галогены являются сильными окислителями, а щелочные металлы - хорошими восстановителями.
Взаимодействие щелочных металлов и галогенов приводит к образованию ионных соединений - солей. Галогены при этом принимают электроны от щелочных металлов, образуя отрицательные ионы (анионы), а щелочные металлы отдают электроны, образуя положительные ионы (катионы).
Например, белый порошок, выделяющий запах хлора, образуется при реакции хлора с натрием:
2Na + Cl2 → 2NaCl
В этом случае, натрий отдаёт один электрон, становясь положительным ионом Na+, в то время как хлор принимает этот электрон, образуя отрицательный ион Cl-. Получившиеся ионы образуют источник соли натрия, который широко используется в пищевой промышленности и бытовой химии.
В результате взаимодействия щелочных металлов и галогенов образуется целый ряд солей, которые обладают разнообразными свойствами и применяются в различных сферах жизни - от промышленности до медицины.
Реакция щелочных металлов с серой

Щелочные металлы, такие как литий, натрий, калий и др., обладают высокой реакционной способностью и могут вступать во взаимодействие с разными элементами, включая серу. Серу можно встретить в различных оксидах и соединениях, и реакция с щелочными металлами может происходить с образованием соответствующих сульфидов.
Реакция щелочных металлов с серой происходит с выделением обильного количества тепла и образованием сероводорода. В результате этой реакции образуется сульфид щелочного металла. Например, реакция натрия с серой выглядит следующим образом:
2 Na + S → Na2S
Сульфиды щелочных металлов обычно образуют ионные соединения. Они обладают высокой растворимостью в воде и хорошей проводимостью электрического тока.
Сульфиды щелочных металлов могут использоваться в различных областях, включая производство химических реагентов, фоточувствительных материалов и в качестве катализаторов в химической промышленности.
Щелочные металлы и группа бора
Щелочные металлы — это элементы 1 группы периодической системы Менделеева: литий, натрий, калий, рубидий, цезий и франций. Они отличаются высокой реактивностью и способностью быстро реагировать с другими веществами. Щелочные металлы обладают свойством образовывать сильно щелочные растворы, поэтому их называют также щелочными. Эти металлы просто реагируют с водой, выделяя водород и образуя гидроксиды, которые растворяются в воде. Однако реактивность щелочных металлов сильно снижается по мере перемещения вниз по группе, что обусловлено увеличением радиуса атома.
Группа бора, включающая бор и алюминий, располагается в 13 группе периодической системы Менделеева. Бор является полуметаллом, который обладает высокой твердостью и высокой температурой плавления. Главными свойствами бора являются его кислотные свойства и способность образовывать соединения с различными элементами. Бор образует стабильный оксид бора (III), который обладает кислотными свойствами. Алюминий, находящийся в той же группе, имеет металлический характер и обладает хорошей проводимостью электрического тока и тепла.
Взаимодействие щелочных металлов и группы бора проявляется в образовании различных соединений. Например, между бором и литием образуется соединение либо в форме многоатомных кластеров, либо в ионно-молекулярной форме. Также наблюдается взаимодействие щелочных металлов с оксидами и галогенами из группы бора, приводящее к образованию стабильных соединений.
Вопрос-ответ

Какие основные свойства щелочных металлов?
Щелочные металлы - элементы первой группы периодической таблицы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают рядом характерных свойств: высокой активностью, низкой электроотрицательностью, низкой плотностью и низким плавлением. Они также хорошо растворяются в воде, образуя щелочные растворы с щелочными свойствами.
Какие вещества вступают в реакцию с щелочными металлами?
Щелочные металлы реагируют с большим количеством веществ, включая воду, кислород, халогены, серу и серные оксиды, аммиак, кислоты и щелочи. В реакциях с водой, наиболее активные щелочные металлы литий, натрий и калий реагируют с образованием щелочной оксид-гидроксида и выделением водорода.
Какие соединения образуют щелочные металлы с аммиаком?
Щелочные металлы образуют соединения с аммиаком, называемые аммидами. Эти соединения имеют общую формулу M(NH2)n, где M - щелочный металл, а n - число аммиачных групп. Аммиды образуются при реакции щелочных металлов с аммиаком при повышенной температуре. Они являются сильными основаниями и могут использоваться в различных химических реакциях.
Какие вещества могут реагировать с щелочными металлами?
Щелочные металлы могут реагировать с большим количеством веществ, включая воду, кислород, халогены, серу и серные оксиды, аммиак, кислоты и щелочи. Они также могут реагировать с некоторыми органическими веществами, такими как спирты и алдегиды. Реакции щелочных металлов с другими веществами могут протекать с выделением тепла и пламени.
