Металлы – это класс химических элементов, характеризующихся способностью образовывать ионные соединения с неметаллами. Они обладают рядом общих химических свойств, которые определяют их уникальность и широкое применение в промышленности, науке и повседневной жизни.
Известным свойством металлов является их способность образовывать гидроксиды при реакции с водой. Например, металл натрий (Na) реагирует с водой, образуя гидроксид натрия (NaOH) и выделяя водород (H₂):
2Na + 2H₂O → 2NaOH + H₂
Это свойство металлов используется, например, при производстве щелочей, таких как каустическая сода, которые широко применяются в различных отраслях промышленности.
Ещё одним важным свойством металлов является их способность образовывать соли. Например, медь (Cu) может образовывать сульфат меди (CuSO₄), реагируя с серной кислотой (H₂SO₄):
CU + H₂SO₄ → CuSO₄ + H₂
Это используется, например, в производстве проводников и конденсаторов, где медь выступает в качестве основного материала.
Металлы: основные химические свойства
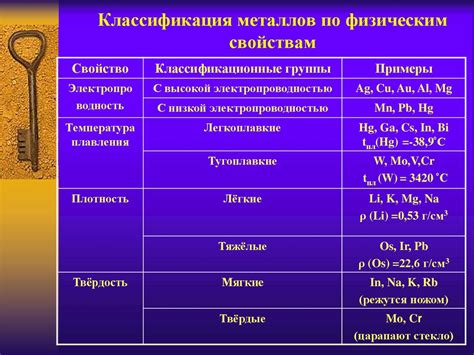
Металлы – это химическая группа элементов, которая обладает рядом характерных химических свойств. Одним из основных свойств металлов является их способность образовывать ионы положительного заряда при химических реакциях. Это связано с тем, что металлы имеют малую электроотрицательность и обладают малым электронным аффинитетом.
Другим важным химическим свойством металлов является их способность реагировать с кислотами. Реакция металлов с кислотами происходит с образованием солей и выделением водорода. В реакции каждого металла с кислотой образуется соответствующая соль, при этом количество выделенного водорода зависит от активности металла.
Металлы также обладают свойством растворятся в растворителях, таких как вода или кислоты. При этом образуется ионное вещество – металлическая соль. Растворимость металлов в растворителях зависит от их активности и электроотрицательности.
Одним из интересных химических свойств металлов является их реакция с кислородом. Некоторые металлы могут гореть на воздухе, образуя оксиды, которые называются металлическими оксидами. Реакция металлов с кислородом может происходить как при нагревании, так и при обычной температуре.
Реакции металлов с кислотами

Металлы могут проявлять свои химические свойства при взаимодействии с кислотами. При этом происходят реакции, в результате которых образуются соли и выделяются водородные газы.
В реакциях металлов с кислотами важную роль играют электроотрицательность металла и кислоты. Чем он выше, тем активнее металл реагирует с кислотами. Например, щелочные металлы, такие как натрий и калий, активно взаимодействуют с сильными кислотами, например, соляной.
Реакции происходят с выделением водородного газа, который можно обнаружить по возникновению пузырьков газа или по характерному звуку приближения горящей спички к области реакции.
Примеры реакций металлов с кислотами:
- Цинк реагирует с соляной кислотой:
- Железо реагирует с серной кислотой:
- Магний реагирует с азотной кислотой:
Zn + 2HCl → ZnCl2 + H2
Fe + H2SO4 → FeSO4 + H2
Mg + 2HNO3 → Mg(NO3)2 + H2
Такие реакции широко применяются в промышленности, в химическом анализе и в повседневной жизни.
Взаимодействие металлов с кислородом

Металлы обладают способностью взаимодействовать с кислородом, что часто приводит к окислительно-восстановительным реакциям. При контакте с кислородом, некоторые металлы начинают активно окисляться и образовывать оксиды. Например, железо при окислении воздухом образует ржавчину – оксид железа (III). Это объясняет почему металлы корродируют и теряют свои свойства в условиях воздействия кислорода.
С другой стороны, взаимодействие металлов с кислородом может протекать и в обратном направлении – восстановление оксидов металлов. Например, при нагревании оксида меди (II) с алюминием происходит реакция, в результате которой образуется металлическая медь и оксид алюминия. Такое взаимодействие металлов с кислородом используется в различных технологических процессах, например, при получении металлов из их руд.
Взаимодействие металлов с кислородом также может проявляться в образовании или разложении перекисных соединений. Например, металлический натрий при контакте с водой образует перекись натрия, которая распадается на гидроксид натрия и кислород. В таких реакциях металлы являются восстановителями, а кислород – окислителем.
Образование оксидов металлов
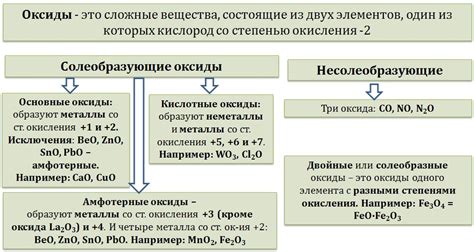
Оксиды металлов - это химические соединения, которые образуются при взаимодействии металлов с кислородом. Образование оксидов металлов является одним из основных химических свойств металлов.
В реакциях образования оксидов металлов металл активно взаимодействует с кислородом, при этом происходит передача электронов от металла к кислороду. Такие реакции могут протекать при нагревании многих металлических веществ на воздухе или при взаимодействии металла с кислородсодержащими соединениями.
Примеры образования оксидов металлов:
- Железо взаимодействует с кислородом при нагревании до красного жара, образуя оксид железа Fe2O3, который имеет красный цвет. Это оксид железа(III), также известный как гематит.
- Цинк образует цинковый оксид ZnO при нагревании на воздухе. Цинковый оксид имеет белый цвет, его используют в производстве керамики и солнечных батарей.
- Алюминий взаимодействует с кислородом даже при обычной комнатной температуре, образуя алюминиевый оксид Al2O3, который известен как корунд. В зависимости от примесей, корунд может быть прозрачным и использоваться для производства алмазов.
Уравнения реакций образования оксидов металлов можно записать следующим образом:
| Металл | Оксид | Уравнение реакции |
|---|---|---|
| Железо | Fe2O3 | 4Fe + 3O2 → 2Fe2O3 |
| Цинк | ZnO | 2Zn + O2 → 2ZnO |
| Алюминий | Al2O3 | 4Al + 3O2 → 2Al2O3 |
Образование оксидов металлов имеет большое практическое значение. Многие оксиды металлов используются в производстве различных материалов, катализаторов и электронных компонентов.
Окислительные свойства металлов
Металлы обладают характерными окислительными свойствами. Они способны переходить в ионное состояние и отдавать электроны в химических реакциях. Это свойство является следствием низкой электротонной активности металлов и их положения в ряду электрохимического ряда.
Окислители реагируют с металлами, превращая их в положительные ионы. В результате этой реакции металл окисляется, а окислитель восстанавливается. Такие реакции проходят со сродственными окислителями, например с кислородом, халогенами, серной кислотой и некоторыми другими соединениями.
Окислительные реакции металлов могут быть представлены уравнениями. Например, реакция меди с кислородом:
- 2Cu + O2 → 2CuO
В данном случае медь окисляется до оксида меди.
Другим примером окислительной реакции является реакция цинка с серной кислотой:
- Zn + H2SO4 → ZnSO4 + H2
Цинк окисляется до иона цинка, а серная кислота восстанавливается до серы и водорода.
Следует отметить, что окислительные свойства металлов также зависят от условий реакции, их степени чистоты, концентрации окислителя и других факторов.
Реакции металлов с водой

Многие металлы реагируют с водой, образуя гидроксиды металлов и выделяя водород. Это явление часто используется для определения металла или его активности. Вода служит в этом случае в качестве окислителя, а металл - в качестве восстановителя.
Металлы можно классифицировать на основе их реакции с водой. Например, активные металлы, такие как литий (Li), натрий (Na) и калий (K), реагируют с водой очень быстро и интенсивно, образуя гидроксиды и выделяя значительное количество водорода. Реакция активных металлов с водой может быть описана уравнением:
2Li + 2H2O → 2LiOH + H2
Также среди металлов есть металлы, которые реагируют с водой незначительно или вообще не реагируют. В таких случаях говорят о их пассивности. Примером пассивных металлов может служить золото (Au), которое не реагирует с водой при нормальных условиях.
Между активными и пассивными металлами существуют промежуточные металлы, у которых реакция с водой происходит медленно. Например, медь (Cu) реагирует с водой, но в растворе образуется карбонат меди, а не гидроксид. Уравнение для этой реакции выглядит следующим образом:
2Cu + 2H2O + CO2 → Cu2(OH)2CO3 + H2
Реакции металлов с водой имеют практическое значение и широко используются в химическом анализе и промышленности.
Взаимодействие металлов с неметаллами

Взаимодействие металлов с неметаллами является одним из важных аспектов химических реакций. При этом, проявляются различные особенности, связанные с химическими свойствами и строением вещества.
Одним из наиболее известных примеров взаимодействия металлов с неметаллами является реакция алкалийных металлов (например, натрия или калия) с водой. При этом возникает сильное химическое взаимодействие, сопровождающееся выделением водорода и образованием гидроксидов металлов. Эта реакция происходит с выделением большого количества тепла и обладает ярко выраженным экзотермическим эффектом.
Кроме того, металлы могут взаимодействовать с кислородом, образуя оксиды. Например, железо может соединиться с кислородом из воздуха, образуя ржавчину. Это проявление является следствием высокой активности металлов и их склонности к окислению воздушным кислородом.
Также следует отметить, что некоторые металлы, например, алюминий и цинк, могут реагировать с кислотами, образуя соли и выделяя водород. Это происходит благодаря их активности и наличию электроотрицательной реакции с кислотными компонентами. Соответствующие реакции могут использоваться, например, в практике экологической очистки и производстве водорода.
Таким образом, взаимодействие металлов с неметаллами проявляется в различных химических реакциях, которые определяют основные химические свойства и применение этих веществ в разных сферах деятельности.
Действие металлов на растворы солей
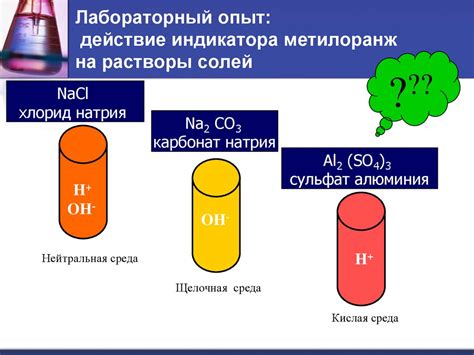
Металлы активной группы, такие как щелочные и щелочноземельные металлы, обладают способностью реагировать с растворами солей и образовывать новые соединения. Данная реакция основана на обмене ионами между металлом и солью.
Процесс реакции металлов с растворами солей может протекать на виду или на слуху. Например, погружая ломтик натрия или кусочек калия в раствор хлорида меди(II), наблюдается яркое горение и появление вспышки. Натрий или калий реагируют с раствором хлорида меди(II), образуя хлорид натрия или хлорид калия и осажденную медь.
В другом случае, кусочек магния, добавленный в раствор серной кислоты, вызывает появление пузырьков газа. Этот газ, выделяющийся при реакции металла с раствором кислоты, это водород. Магний вступает в реакцию с серной кислотой, образуя сернистый ангидрид и водород.
Таким образом, взаимодействие металлов с растворами солей может вызывать различные виды реакций, такие как окислительно-восстановительные, обменные и гидролизные реакции. Эти реакции важны не только с точки зрения исследования основных химических свойств металлов, но и имеют практическое значение в промышленности и быту.
Свойства металлов в жидком состоянии
Металлы обладают рядом уникальных химических свойств, проявляющихся и в их жидком состоянии. Когда металлы нагреваются до температур выше их точки плавления, они переходят в жидкую фазу. В жидком состоянии металлы сохраняют свою металлическую структуру, что делает их отличными проводниками электричества и тепла.
Однако свойства металлов в жидком состоянии могут отличаться от их свойств в твердом состоянии. Например, плотность металлов часто снижается при переходе в жидкую фазу. Кроме того, металлы в жидком состоянии становятся более подвижными и способными к химическим реакциям.
Металлы в жидком состоянии могут реагировать с другими веществами, образуя различные соединения. Например, алюминий в жидком состоянии может диспропорционировать, образуя алюминийгидрид (AlH3) и газообразный водород. Этот процесс может быть описан следующим уравнением реакции: 2Al(l) → AlH3(s) + H2(g).
Металлы в жидком состоянии также могут растворяться в других материалах, образуя сплавы. Сплавы могут иметь различные физические и химические свойства, в зависимости от пропорций исходных металлов. Например, железо в жидком состоянии может растворяться в никеле, образуя никелевые сплавы, которые обладают высокой коррозионной стойкостью и механической прочностью.
Вопрос-ответ

Какие основные свойства металлов можно выделить?
Основные свойства металлов: хорошая теплопроводность, электропроводность, металлический блеск, пластичность и прочность.
Какие реакции могут происходить с металлами?
Металлы могут реагировать с кислородом, водой, кислотами и щелочами. Например, с кислородом могут происходить окислительно-восстановительные реакции, а с кислотами ищелочами - реакции образования солей.
