Оксиды металлов являются одной из наиболее распространенных и важных классов неорганических соединений. Они представляют собой химические соединения, состоящие из металлического и кислородного атомов. Оксиды металлов обладают широким спектром свойств и играют важную роль в различных областях науки и технологии.
Одной из основных характеристик оксидов металлов является их окислительная способность. Большинство оксидов металлов обладают способностью переходить к более высоким степеням окисления и отдавать кислородные атомы. Это свойство позволяет использовать оксиды металлов в качестве катализаторов в различных реакциях.
Оксиды металлов также обладают различными физическими и химическими свойствами. Они могут быть кислыми, щелочными или амфотерными, в зависимости от природы металла. Как правило, оксиды металлов образуют кристаллические структуры, которые дают им определенную форму и твердость.
Важным свойством оксидов металлов является их способность взаимодействовать с другими веществами, в том числе с водой, кислотами и щелочами. Некоторые оксиды металлов растворяются в воде, образуя щелочные или кислые растворы. Это свойство используется в промышленности и в лабораторных условиях для получения различных соединений.
Определение и классификация оксидов металлов
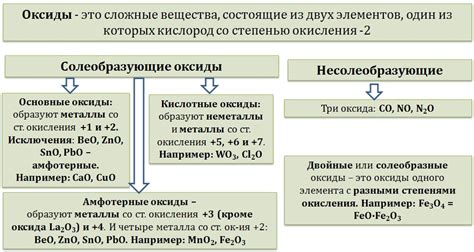
Оксиды металлов представляют собой химические соединения, состоящие из атомов металла и кислорода. Они являются основными оксидами, так как реагируют с водой, образуя щелочные растворы. Оксиды металлов обладают различными свойствами и использованием.
Оксиды металлов классифицируются по ионной формуле в соответствии с валентностью металла. Оксиды одноатомных металлов выражаются в форме MO, где M - символ металла. Оксиды двухатомных металлов записываются в форме MnOm, где n и m - числа, указывающие валентность металла и количество атомов кислорода соответственно.
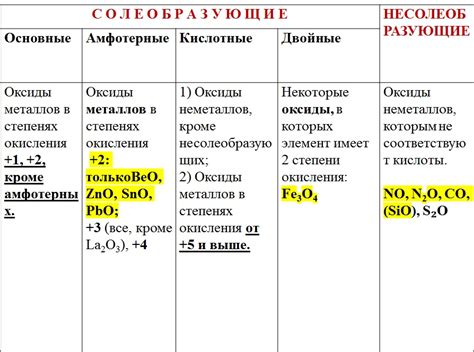
Среди основных классов оксидов металлов можно выделить:
- Основные оксиды, которые образуют щелочные растворы и имеют валентность металла +1 или +2.
- Амфотерные оксиды, которые могут взаимодействовать как с кислотами, так и с щелочами.
- Кислотные оксиды, которые образуют кислоты при реакции с водой. Имеют валентность металла +3 или выше.
Кроме того, оксиды металлов могут иметь различные структуры, включая ионные, ковалентные и металлические. Они также могут образовывать полимерные структуры или быть атомарными соединениями. Все эти свойства определяют химические и физические свойства оксидов металлов и их использование в различных отраслях промышленности.
Химический состав и структура оксидов металлов

Оксиды металлов представляют собой соединения металлов с кислородом. Химический состав оксидов металлов определяется их формулой, которая указывает наличие и соотношение атомов металла и кислорода. Например, оксид алюминия имеет формулу Al2O3, что означает наличие двух атомов алюминия и трех атомов кислорода в молекуле.
Структура оксидов металлов может быть разнообразной. Одни оксиды образуют кристаллическую решетку, в которой атомы металла и кислорода расположены в определенном порядке. Например, оксид железа(III) образует кристаллическую структуру гидравлически близкую к структуре корунда. Другие оксиды могут иметь аморфную структуру, в которой атомы расположены более хаотично.
Оксиды металлов могут быть однородными соединениями, в которых атомы металла и кислорода равномерно распределены в пространстве, или быть двух- и трехкомпонентными системами. Например, в оксиде железа(III) присутствуют два типа атомов железа и три типа атомов кислорода. Такое распределение атомов в структуре оксидов металлов влияет на их физические и химические свойства, такие как плотность, температура плавления и растворимость.
Физические свойства оксидов металлов

Оксиды металлов представляют собой химические соединения, состоящие из металла и кислорода. Они обладают рядом характерных физических свойств, которые определяют их поведение и применение в различных областях.
Во-первых, оксиды металлов обычно имеют высокую температуру плавления и кипения. Это связано с прочными химическими связями между атомами металла и кислорода. Поэтому оксиды металлов часто используются в высокотемпературных процессах и материалах.
Во-вторых, оксиды металлов обычно являются твердыми веществами, но некоторые из них могут быть и газами или жидкостями при комнатной температуре и давлении. Это зависит от химического состава и структуры оксида. Например, оксид алюминия (Al2O3) является твердым веществом, а оксид азота (NO2) - газом.
Третье важное свойство оксидов металлов - их электропроводность. Оксиды металлов, в зависимости от своей структуры, могут быть как электропроводными, так и непроводящими. Например, оксид меди (CuO) обладает полупроводниковыми свойствами, в то время как оксид алюминия (Al2O3) не проводит электричество.
Наконец, некоторые оксиды металлов обладают магнитными свойствами. Например, оксид железа (Fe2O3) является антиферромагнетиком, то есть обладает слабыми магнитными свойствами при низких температурах.
В целом, физические свойства оксидов металлов разнообразны и зависят от их химического состава и структуры. Эти свойства определяют возможности использования оксидов металлов в различных областях, от металлургии до электроники.
Химические свойства оксидов металлов
Оксиды металлов – это химические соединения, в состав которых входит металл и кислород. Они обладают рядом особых свойств, которые определяют их химическую активность и практическое применение.
Одно из основных свойств оксидов металлов – их способность взаимодействовать с водой или кислотами, образуя основные растворы. В результате таких реакций оксиды металлов облагораживаются и становятся растворимыми в воде. Например, оксид натрия (Na2O) с раствором воды образует гидроксид натрия (NaOH), который обладает щелочными свойствами.
Другое важное химическое свойство оксидов металлов – их реакционная способность с кислородом. Оксиды металлов могут взаимодействовать с кислородом при нагревании или в присутствии катализаторов. Такие реакции приводят к образованию перекисей и на них основано получение многих важных химических веществ, таких как водород пероксид, ацетонпероксид и др.
Также оксиды металлов являются основными оксидами и реагируют с кислотами, образуя соль и воду. Например, оксид меди (CuO) реагирует с соляной кислотой (HCl) и образует хлорид меди (CuCl2) и воду (H2O). Такие реакции используются в химическом синтезе и промышленности.
И, наконец, оксиды металлов могут проявлять амфотерные свойства – способность взаимодействовать и с кислотами, и с основаниями. Это свойство обусловлено наличием в молекуле оксида как кислотной, так и основной активных центров. В результате такой реакции образуются соли металлов, которые могут быть как кислыми, так и щелочными. Например, оксид алюминия (Al2O3) реагирует как с соляной кислотой, так и с щелочью, образуя соли алюминия – алюминийхлорид (AlCl3) и алюминий сульфат (Al2(SO4)3).
Роль оксидов металлов в природных и технических процессах

Оксиды металлов являются важными компонентами в природных и технических процессах, выполняя различные роли и функции.
В природных процессах, оксиды металлов играют важную роль в геохимических циклах, так как многие металлы находятся в природе в виде оксидов. Например, оксид железа (Fe2O3), известный как гематит, является одним из главных компонентов земной коры и играет ключевую роль в цикле железа. Оксиды металлов также встречаются в форме минералов, таких как магнетит (Fe3O4) и рутил (TiO2), которые используются в процессах добычи и обработки полезных ископаемых.
В технических процессах оксиды металлов широко применяются в различных отраслях промышленности. Оксид алюминия (Al2O3), известный как алюминий, используется в производстве алюминия, керамики, стекла и других материалов. Оксиды цинка (ZnO) и титана (TiO2) используются в производстве красок, пигментов и солнцезащитных средств. Оксиды меди (Cu2O и CuO) применяются в производстве электродов, суперпроводников и полупроводниковых материалов.
Оксиды металлов также имеют важное значение в электрохимии и каталитических процессах. Например, оксид цинка используется в анодах электроводородных энергетических установок, а оксид железа применяется в катализаторах для водородации органических соединений.
Таким образом, оксиды металлов играют важную роль в природных и технических процессах, обеспечивая необходимые свойства и функциональность в различных областях науки и промышленности.
Влияние оксидов металлов на окружающую среду

Оксиды металлов являются важным источником загрязнения окружающей среды. Они образуются в результате процессов сгорания топлива, промышленных выбросов и природных явлений, таких как вулканическая активность. Их влияние на окружающую среду зависит от различных факторов, таких как концентрация, растворимость и токсичность.
Оксиды металлов могут вредить здоровью человека и животных. Вдыхание их аэрозолей может привести к различным респираторным проблемам, включая астму, бронхит и другие заболевания дыхательной системы. Некоторые оксиды металлов могут быть канцерогенными и вызывать рак. Одним из наиболее известных примеров является свинецоксид, который может вызывать отравление свинцом.
Оксиды металлов также оказывают негативное влияние на растительный мир. Уровень воздействия зависит от концентрации оксидов металлов и способности растений переносить их. Высокие концентрации оксидов могут повреждать клетки растений, их корни и листья, что может привести к ухудшению фотосинтеза и, в конечном счете, смерти растения.
Оксиды металлов также оказывают влияние на водные экосистемы. Они могут проникать в поверхностные воды через атмосферу или сточные воды, загрязняя водные ресурсы и вредя животным и растениям, обитающим в воде. Они также могут вызывать изменение pH-уровня воды, что влияет на рыб и других водных организмов.
Таким образом, оксиды металлов имеют значительное влияние на окружающую среду, воздействуя на здоровье людей и животных, а также вызывая негативные последствия для растительного и водного мира. Снижение выбросов оксидов металлов в атмосферу и ограничение их использования являются важными задачами для защиты окружающей среды и обеспечения устойчивого развития.
Применение оксидов металлов в различных отраслях промышленности

1. Металлургия
Оксиды металлов широко используются в металлургическом производстве. Например, оксид цинка (ZnO) применяется в процессе производства луженой стали, а оксид алюминия (Al2O3) используется для обработки металлических поверхностей и получения покрытий с высокой твердостью и износостойкостью.
2. Химическая промышленность
Оксиды металлов играют важную роль в химической промышленности. Например, оксид титана (TiO2) используется в процессе производства красителей, пластиков, косметических продуктов и солнцезащитных средств. Оксиды меди (CuO, Cu2O) применяются в электронике для создания проводников и полупроводников.
3. Энергетика
Оксиды металлов также находят применение в энергетической отрасли. Например, оксид железа (Fe2O3) используется в производстве катодов для гальванических элементов и аккумуляторов. Оксид свинца (PbO2) применяется в процессе производства аккумуляторов и суперконденсаторов.
4. Строительство
В строительной отрасли оксиды металлов используются для создания различных материалов с требуемыми свойствами. Например, оксид кремния (SiO2) используется в производстве стекла, керамики и строительных материалов. Оксид алюминия (Al2O3) применяется в производстве огнеупорных материалов и керамических покрытий.
5. Авиационная и космическая промышленность
В авиационной и космической отраслях оксиды металлов используются для создания высокопрочных и легких материалов. Например, оксид титана (TiO2) применяется для создания теплоизоляционных покрытий и композитных материалов. Оксид алюминия (Al2O3) используется для производства керамических композитов и защитных покрытий.
Таким образом, оксиды металлов имеют широкое применение в различных отраслях промышленности, благодаря своим уникальным физическим и химическим свойствам.
Перспективы исследований оксидов металлов

Оксиды металлов представляют собой класс веществ, которые имеют широкий спектр свойств и потенциальных применений. Исследования в области оксидов металлов открывают новые перспективы для развития различных областей науки и технологий.
Одной из основных перспектив исследований оксидов металлов является разработка новых материалов с улучшенными свойствами. Оксиды металлов обладают разнообразными физическими и химическими свойствами, которые позволяют создавать материалы с различной проводимостью, оптическими и магнитными свойствами, высокой прочностью и стойкостью к воздействию внешних факторов.
Исследования оксидов металлов также имеют большое значение для разработки новых катализаторов. Оксиды металлов могут использоваться в качестве активных компонентов катализаторов для различных химических процессов. Исследования в этой области направлены на повышение эффективности катализаторов и сокращение затрат на их производство.
Другой перспективной областью исследований оксидов металлов является их применение в электрохимии. Оксиды металлов обладают способностью к хранению и передаче электрической энергии, что открывает новые возможности для создания более эффективных аккумуляторов и электролизеров. Исследования в этой области направлены на повышение энергоемкости и стабильности оксидных материалов.
Таким образом, исследования оксидов металлов являются важным направлением научных исследований. Они способствуют развитию новых материалов, катализаторов и электрохимических систем, которые могут найти широкое применение в различных отраслях науки и технологий.
Вопрос-ответ

Какие свойства имеют оксиды металлов?
Оксиды металлов обладают рядом характеристических свойств. Во-первых, они являются химическими соединениями, состоящими из металла и кислорода. Во-вторых, обычно оксиды металлов обладают высокой температурой плавления и кипения, что делает их основными оксидами. Они обладают сильным щелочным характером и растворяются в воде, образуя щелочные растворы. Еще одним свойством оксидов металлов является их способность взаимодействовать с кислотами, образуя соли. Некоторые оксиды металлов также обладают полупроводниковыми свойствами и применяются в электронике.
Что такое основные оксиды?
Основные оксиды – это оксиды, которые обладают щелочными свойствами. Они растворяются в воде, образуя щелочные растворы. Основные оксиды играют важную роль в химических реакциях и используются в различных областях, включая производство щелочей, стекол, эмалей и керамики. Некоторые основные оксиды, такие как кальция и магния, также используются в строительной промышленности и сельском хозяйстве.
Какие металлы образуют оксиды?
Практически все металлы способны образовывать оксиды. Некоторые из наиболее распространенных оксидообразующих металлов включают алюминий, железо, медь, свинец, цинк, магний, кальций и натрий. Каждый металл имеет свои характерные свойства оксида, включая цвет, степень растворимости и способность взаимодействовать с другими веществами.
Какие применения имеют оксиды металлов?
Оксиды металлов имеют широкий спектр применений. Например, оксид кремния используется в производстве стекла, керамики и электронных компонентов. Оксид алюминия, также известный как глина, используется для производства керамики, алюминиевых сплавов и огнеупорных материалов. Оксид цинка применяется в производстве резиновых изделий и косметических продуктов. Оксиды металлов также используются в качестве катализаторов в химической промышленности и электронике.
