Металлы обладают рядом уникальных свойств, которые делают их важными и полезными материалами в различных отраслях промышленности. Они характеризуются высокой теплопроводностью, электропроводностью, пластичностью и прочностью. Благодаря этим свойствам, металлы широко используются в производстве машин и оборудования, строительстве, электронике и других отраслях.
Одним из ключевых свойств металлов является их способность образовывать реакции с различными веществами. Реакции металлов могут быть описаны с помощью химических уравнений, которые показывают, как металл взаимодействует с другими веществами и какие продукты образуются в результате этой реакции.
Основной тип реакции металлов – окисление. Металлы могут реагировать с кислородом воздуха или с веществами, содержащими кислород, образуя окислы. Например, железо при окислении образует ржавчину, а алюминий образует окись алюминия. Однако, не все металлы реагируют с кислородом одинаково. Некоторые металлы являются активными и быстро окисляются, такие как натрий или калий, а другие металлы, такие как золото или платина, практически не реагируют с кислородом.
Физические свойства металлов
Металлы – это химические элементы, характеризующиеся высокой теплопроводностью, электропроводностью и металлическим блеском. Помимо этих общих свойств, металлы также обладают рядом других физических характеристик.
Точка плавления и кипения. У большинства металлов точка плавления и кипения высокая, что связано с прочной металлической связью между атомами. Например, точка плавления железа составляет около 1538 °C, а точка кипения – 2862 °C.
Плотность. Металлы обладают высокой плотностью в сравнении с другими материалами. Например, плотность свинца составляет около 11,3 г/см³, что делает его одним из самых тяжелых металлов.
Пластичность. Металлы обладают высокой пластичностью, то есть способностью изменять форму без разрушения. Благодаря этому свойству металлы могут быть прокатаны в проволоку или листы, а также служить сырьем для изготовления различных изделий.
Теплоемкость. Металлы обладают высокой теплоемкостью, что означает, что им требуется большое количество теплоты для нагревания. Это свойство может быть использовано для создания материалов, способных сохранять тепло, например, для применения в термосах или теплоизоляции.
Электропроводность. Металлы являются хорошими проводниками электричества благодаря наличию свободных электронов в своей структуре. Именно благодаря этому свойству металлы широко применяются в электротехнике и электронике.
В целом, физические свойства металлов обусловлены их структурой и особенностями взаимодействия атомов в кристаллической решетке. Эти свойства определяют широкое применение металлов в промышленности, строительстве, энергетике и других отраслях экономики.
Химические свойства металлов

Химические свойства металлов являются одними из наиболее характерных и важных свойств этих веществ. Они определяются особенностями строения и устройства атомов металлов, а также их электронной структурой.
Одной из наиболее характерных химических свойств металлов является их способность образовывать ионы положительного заряда, то есть катионы. Это связано с тем, что у атомов металлов внешний слой электронов обычно содержит меньше электронов, чем полный слой. Поэтому металлы имеют тенденцию отдавать электроны другим веществам, образуя положительно заряженные ионы.
Металлы также обладают способностью образовывать металлические связи. Эти связи состоят в том, что свободные электроны отдельных атомов перемещаются по металлической структуре и образуют электронное облако. Это облако электронов даёт металлу его характерные металлические свойства, такие как достаточная электропроводность, хорошая теплопроводность, пластичность и т.д.
Особенностью химических реакций металлов является их способность вступать в реакции с кислотами, в результате которых образуются соли. Эта реакция называется металлокислотной. Она основывается на способности металлов сопротивляться окислению и уступать электроны кислородным реагентам, образуя воду.
Также металлы могут образовывать соединения с неметаллами, например, с галогенами. Эти соединения обычно являются солью металла и галогена. В таких реакциях металлы способны уступать свои электроны неметаллам, образуя ионы галогена и катионы металла.
Уравнения реакций металлов с кислотами
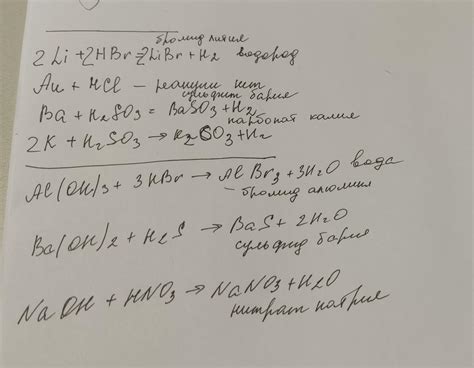
Металлы активные химические элементы, которые образуют ионы положительного заряда в процессе химических реакций. Столь широкое распространение металлов в нашей жизни объясняется их свойствами, включая их реакционную способность.
Одной из наиболее известных химических реакций металлов является их взаимодействие с кислотами. При этом образуется соль и выделяется водород. Уравнение реакции записывается в виде: металл + кислота → соль + водород. Важным моментом при записи уравнений реакций является учёт стехиометрических коэффициентов, которые показывают соотношение между реагентами и продуктами.
Например, реакция алюминия с серной кислотой можно записать следующим образом: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2. В этом уравнении видно, что две молекулы алюминия реагируют с тремя молекулами серной кислоты, образуя соль алюминия и три молекулы водорода.
Реакции металлов с кислотами происходят в широком диапазоне температур и начинаются с образования активного металлица. Далее происходит электролитический процесс, при котором ионы металла переходят на электрод и взаимодействуют с атомами водорода. В результате образуется соль, а избыток водорода выделяется в виде газа.
Уравнения реакций металлов с кислотами не только являются важными в химических процессах, но и имеют практическое применение. Реакции этого типа широко используются при производстве солей, водорода и других продуктов.
Особенности реакций металлов с водой

Реакция металлов с водой является одной из основных характеристик их химической активности. Особенности этой реакции определяются свойствами металла и условиями проведения эксперимента.
При взаимодействии металлов с водой обычно происходит образование гидроксида и выделение водорода. Однако не все металлы взаимодействуют с водой одинаково. Некоторые металлы, такие как натрий и калий, реагируют с водой очень активно и даже могут вызывать взрывоопасные реакции. Другие, такие как железо и медь, могут реагировать с водой только при нагревании либо при наличии специальных катализаторов.
Кроме того, реакция металлов с водой может протекать с различной интенсивностью. Некоторые металлы, например литий, реагируют с водой очень быстро, с выделением большого количества водорода и образованием гидроксида. Другие, например железо, взаимодействуют с водой медленно и без видимых признаков химической реакции.
Также, в зависимости от условий проведения эксперимента, реакция металлов с водой может протекать по-разному. Например, если металл находится в виде порошка или стружки, реакция будет протекать более интенсивно, чем если металл находится в виде сплава либо оксида. Кроме того, реакция металлов с водой может быть существенно замедлена в присутствии растворов солей или газов, таких как соляная кислота или углекислый газ.
Металлы и их реакции с кислородом

Металлы – это элементы, обладающие характерными свойствами, такими как блеск, хорошая теплопроводность и электропроводность. Одним из важных свойств металлов является их реакционная способность, в частности, реакции с кислородом.
Реакция металлов с кислородом приводит к образованию оксидов металлов. Оксиды металлов представляют собой химические соединения, состоящие из металла и кислорода. Образование оксидов является неизбежным при взаимодействии металла с кислородом воздуха.
Реакция металлов с кислородом происходит со значительным выделением тепла. Она является экзотермической, то есть сопровождается выделением энергии. Это объясняет наблюдаемое плавление и горение металлов при их реакции с кислородом.
Реакция металлов с кислородом также может привести к образованию оксида со специфическими свойствами. Например, реакция железа с кислородом приводит к образованию оксида железа, который имеет характерный ржавый цвет и обладает способностью к коррозии.
В таблице ниже приведены примеры реакций металлов с кислородом:
| Металл | Реакция с кислородом (О2) | Образовавшийся оксид |
|---|---|---|
| Магний | 2Mg + O2 → 2MgO | Магниевый оксид (Магниевая основа) |
| Алюминий | 4Al + 3O2 → 2Al2O3 | Алюминиевый оксид |
| Железо | 4Fe + 3O2 → 2Fe2O3 | Оксид железа (Ржавчина) |
Таким образом, реакции металлов с кислородом являются важным аспектом их химической активности. Образование оксидов металлов при взаимодействии с кислородом может иметь как полезное, так и нежелательное значение в промышленности и повседневной жизни.
Вопрос-ответ

Какие свойства металлов отличают их от других элементов?
Металлы обладают рядом особенных свойств, которые отличают их от других химических элементов. Во-первых, металлы обладают высокой электропроводностью, что позволяет им передавать электрический ток. Во-вторых, металлы обычно обладают высокой теплопроводностью, что означает их способность эффективно передавать тепло. Кроме того, металлы обычно обладают высокой пластичностью и могут легко деформироваться без разрушения. Они также имеют блеск, известный как металлический блеск.
Как металлы реагируют с водой?
Реакция металлов с водой может варьироваться в зависимости от конкретного металла. Некоторые металлы, такие как натрий и калий, реагируют с водой с выделением водорода и образованием щелочи. Другие металлы, такие как железо и цинк, не реагируют с водой при обычных условиях, однако могут реагировать с паром воды или с кислотами. Некоторые металлы, такие как магний и алюминий, реагируют с водой только при наличии катализатора, например, кислоты или щелочи.
Какие уравнения реакций могут описывать реакции металлов с кислотами?
Реакция металла с кислотой может быть представлена следующим уравнением: металл + кислота ⟶ соль + водород. Например, реакция железа с соляной кислотой может иметь следующее уравнение: Fe + 2HCl ⟶ FeCl₂ + H₂. В данном случае железо реагирует с соляной кислотой, образуется хлорид железа и выделяется водород.
Как можно проверить наличие металла в растворе?
Для определения наличия металла в растворе можно использовать различные методы. Один из таких методов - добавление реагента, способного образовывать осадок с определенными металлами. Например, если в раствор добавить гидроксид натрия и образуется белый осадок, это может указывать на присутствие алюминия. Также можно использовать электроанализ, спектральный анализ и другие методы для определения наличия металла в растворе.
