Щелочные металлы – это элементы периодической таблицы, которые относятся к первой группе. Основными представителями этой группы являются литий, натрий, калий, рубидий и цезий. Щелочные металлы обладают химической активностью и хорошо растворяются в воде. Одной из основных особенностей этих металлов является образование радикалов щелочных металлов при взаимодействии с водой.
Основные соединения щелочных металлов имеют широкое применение в различных областях. Например, гидроксиды щелочных металлов (натрия, калия, лития) являются основными компонентами многих бытовых и промышленных моющих средств. Они обладают высокой щелочностью и эффективно справляются с известковыми отложениями и жирными загрязнениями.
Формулы основных соединений щелочных металлов также следует запомнить. Например, гидроксид натрия имеет формулу NaOH, а гидроксид калия – KOH. Кроме того, щелочные металлы формируют соль, образуемую при реакции щелочного металла с кислотой, которая имеет формулу MCl, где М – металл. Например, соль натрия получается при реакции натрия с хлороводородной кислотой – NaCl.
Соединения щелочных металлов обладают рядом свойств, их знание является важным в химической науке и промышленности. Благодаря своей активности и реакционной способности, они широко применяются в производстве различных продуктов, в том числе и в фармацевтической и пищевой промышленности.
Таким образом, знание формул и свойств основных соединений щелочных металлов является важным для понимания их химических свойств и широкого спектра применения.
Основные соединения щелочных металлов

Щелочные металлы - это группа химических элементов, включающая литий, натрий, калий, рубидий и цезий. В природе они встречаются только в соединениях, так как очень реактивны. Основными соединениями щелочных металлов являются оксиды, гидроксиды, карбонаты и соли.
Оксиды щелочных металлов обладают свойством давать щелочные растворы при реакции с водой. Например, оксид лития (Li2O) при контакте с водой образует гидроксид лития (LiOH). Оксиды щелочных металлов также используются в процессе синтеза различных соединений и материалов.
Гидроксиды, или щелочные гидроксиды, щелочные основания - это соединения щелочных металлов с гидроксильной группой OH-. Гидроксиды щелочных металлов обладают щелочными свойствами и широко используются в различных отраслях, в том числе в производстве мыла, стекла и щелочных аккумуляторных батарей.
Карбонаты щелочных металлов являются солью угольной кислоты (H2CO3), которая образуется при растворении углекислого газа (CO2) в воде. Карбонаты щелочных металлов используются для производства стекла, моющих средств, пищевых добавок и в других отраслях промышленности.
Соли щелочных металлов являются результатом реакции оксидов или гидроксидов щелочных металлов с кислотами. Соли, такие как нитраты, сульфаты, хлориды и другие, имеют широкое применение в различных областях, включая производство удобрений, пищевой промышленности и фармацевтике.
Химические соединения щелочных металлов

Щелочные металлы - это группа элементов, которые расположены в первой группе периодической системы. Эти металлы характеризуются низкой плотностью и низким температурным плавлением. Щелочные металлы включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Щелочные металлы образуют различные химические соединения с другими элементами. Базовым химическим соединением щелочных металлов является гидроксид металла, который образуется при реакции щелочного металла с водой. Например, натрий образует натриевый гидроксид (NaOH), калий образует гидроксид калия (KOH) и так далее.
Щелочные металлы также образуют соли, которые представляют собой ионы металла, связанные с отрицательно заряженными ионами. Натрий, калий и другие щелочные металлы могут образовывать соли с различными анионами, такими как хлорид (Cl-), сульфат (SO42-), карбонат (CO32-) и другими.
Щелочные металлы также образуют комплексные соединения, в которых металл связан с одним или несколькими лигандами (атомами или молекулами, образующими связь с металлом). Комплексные соединения щелочных металлов широко используются в различных областях, таких как катализаторы, медицина и материаловедение.
Таблица ниже показывает некоторые химические соединения щелочных металлов:
| Металл | Соединение |
|---|---|
| Литий | Литий гидроксид (LiOH) |
| Натрий | Натриевый хлорид (NaCl) |
| Калий | Калиевый нитрат (KNO3) |
| Рубидий | Рубидиевая свинчива (RbCrO4) |
| Цезий | Цезиевый хлорид (CsCl) |
Химические соединения щелочных металлов имеют различные свойства и широко используются в различных отраслях науки и техники.
Формулы и названия часто встречающихся соединений
Гидроксид натрия (NaOH) - это одно из наиболее распространенных соединений щелочных металлов. Он также известен под названием пищевая сода или сода натрия. Гидроксид натрия является белым кристаллическим веществом, растворимым в воде и широко используется в производстве бытовых и химических продуктов.
Карбонат лития (Li2CO3) - это соединение щелочного металла лития. Оно представляет собой белый аморфный порошок, который также растворим в воде. Карбонат лития используется в медицине для лечения биполярного расстройства и депрессии, а также в электрохимической промышленности.
Нитрат калия (KNO3) - это соединение щелочного металла калия. Оно имеет белый или бесцветный кристаллический вид и широко используется в пищевой и сельскохозяйственной промышленности. Нитрат калия также называется селитрой и используется в производстве взрывчатых веществ и удобрений.
Хлорид цезия (CsCl) - это соединение щелочного металла цезия. Оно представляет собой белые кристаллы с соленым вкусом. Хлорид цезия используется в научных исследованиях, в медицине и в производстве фотоэлементов.
Гидроксид калия (KOH) - это соединение щелочного металла калия. Оно представляет собой белые кристаллы, растворимые в воде. Гидроксид калия используется в различных отраслях промышленности, включая производство мыла, стекла и удобрений.
Сульфат магния (MgSO4) - это соединение щелочноземельного металла магния. Оно имеет белый цвет и широко используется в медицине и сельском хозяйстве. Сульфат магния также называется эпсомской солью и используется в ваннах для расслабления мышц и улучшения состояния кожи.
Свойства химических соединений щелочных металлов
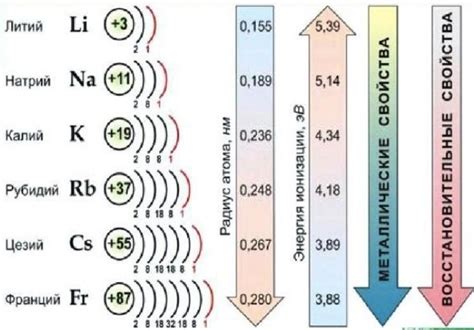
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, образуют различные химические соединения с другими элементами. Эти соединения обладают рядом уникальных свойств, которые влияют на их использование в различных областях науки и технологий.
Первым важным свойством щелочных металлов является высокая электроотрицательность, что позволяет им образовывать ионы с положительным зарядом в реакциях с другими элементами. Это также делает щелочные металлы хорошими веществами для проведения электролиза и создания электрических аккумуляторов.
Другим важным свойством щелочных металлов является их способность образовывать сильные основания. Они образуют гидроксиды с водой, которые обладают высокой щелочностью. Это объясняет, почему щелочные металлы являются хорошими ингредиентами для производства мыла, моющих средств и других продуктов, которые требуют щелочных условий.
Еще одним важным свойством химических соединений щелочных металлов является их способность образовывать сольные кристаллы. Эти кристаллы обладают высокой структурной стабильностью и могут образовывать сложные трехмерные сетевые структуры. Именно из-за этого свойства щелочные металлы используются в процессе производства стекла, керамики и других материалов, где требуется высокая прочность и стабильность.
Наконец, щелочные металлы также обладают высокой электропроводностью. Это связано с их способностью образовывать ионы с положительным зарядом и обеспечивать передачу электрического тока. Именно поэтому щелочные металлы широко используются в производстве батарей и других электронных устройств.
Главные способы получения соединений щелочных металлов

Щелочные металлы входят в первую группу периодической системы элементов и образуют различные соединения с другими элементами. Главными способами получения соединений щелочных металлов являются:
- Прямое соединение. Этот способ основан на прямой реакции щелочного металла с другим веществом. Например, натрий может реагировать с кислородом и образовывать оксид натрия.
- Реакция с кислотой. Щелочные металлы активно взаимодействуют с кислотами и образуют соли. Например, реакция натрия с соляной кислотой приводит к образованию хлорида натрия.
- Реакция с водой. Щелочные металлы очень активны и легко реагируют с водой, освобождая водород. Этот процесс известен как реакция щелочного металла с водой. Например, реакция калия с водой приводит к образованию гидроксида калия и выделению водорода.
- Электролиз. Соединения щелочных металлов могут быть получены путем электролиза их расплавленных солей. Этот метод широко используется в промышленности для получения металлов и их соединений.
Многие соединения щелочных металлов имеют широкое применение в различных областях, включая промышленность, медицину и сельское хозяйство. Изучение способов получения этих соединений позволяет более эффективно использовать их в практике и синтезировать новые соединения для различных целей.
Применение соединений щелочных металлов в различных отраслях промышленности

1. Металлургия:
Соединения щелочных металлов имеют широкое применение в металлургической отрасли. Например, сера амиачная (NH4)2SO4, получаемая из аммиака и серной кислоты, используется при очистке металлов от оксидов, сернистых соединений и других примесей. Кроме того, гидроксиды щелочных металлов используются для нейтрализации кислотных отходов и обезроживания стали, а карбонаты щелочных металлов - для производства стекла.
2. Химическая промышленность:
Соединения щелочных металлов также широко используются в химической промышленности. Калий и натрий входят в состав многих химических соединений, таких как гидроксиды (натрия, калия) и карбонаты (натрия, калия). Вода соединений щелочных металлов используется в процессе синтеза ряда химических реакций. Кроме того, щелочные металлы используются в производстве щелочных и алкалийных элементов, неорганических кислот и многочисленных органических соединений.
3. Энергетика и батарейная промышленность:
Щелочные металлы нашли применение в энергетической отрасли. Практически все типы аккумуляторов, от обычных сухих электрохимических элементов до сложных литий-ионных и никель-металл-гидридных аккумуляторов, используют щелочные металлы в качестве основного активного элемента. Кроме того, соединения лития нашли применение в производстве ядерных реакторов и ядерных батарей, обеспечивающих энергией межпланетные и космические аппараты.
4. Медицина и фармацевтика:
В медицине и фармацевтике соединения щелочных металлов применяются в качестве лекарственных препаратов и добавок к пище. Натрий и калий являются необходимыми ионами для нормального функционирования организма. Щелочные металлы также играют важную роль в регулировании кислотно-щелочного баланса организма и участвуют в метаболических процессах.
5. Производство грунтовых грунтовых грунтов:
Соединения щелочных металлов используются в с.-х. для улучшения почвенных условий и повышения плодородности. Гидроксиды щелочных металлов используются для нейтрализации кислых почв, а карбонаты - для увеличения щелочности и буферности почвы. Кроме того, некоторые соединения щелочных металлов применяются как питательные вещества для растений или при нормализации водного режима почвы.
Вопрос-ответ

Какие есть основные соединения щелочных металлов?
Основные соединения щелочных металлов включают гидроксиды, кислотные соли и оксиды. Гидроксиды щелочных металлов имеют общую формулу MOH, где M - щелочной металл. Кислотные соли имеют формулу MX, где X - неметал. А оксиды щелочных металлов имеют формулу MO.
Какие свойства характерны для гидроксидов щелочных металлов?
Гидроксиды щелочных металлов обладают следующими свойствами: они являются каркасными соединениями и образуют кристаллическую решетку, они растворяются в воде, образуя щелочные растворы, они обладают щелочными свойствами и образуют гидроксидные ионы OH-, они эндотермические соединения и при растворении поглощают тепло.
