Щелочноземельные металлы, такие как бериллий, магний, кальций, стронций, барий и радий, являются важными элементами в химии и промышленности. Они имеют множество соединений, каждое из которых обладает уникальными свойствами и применениями.
Соединения щелочноземельных металлов можно разделить на несколько категорий. В первую группу входят оксиды, которые образуются при соединении металлов с кислородом. Оксиды щелочноземельных металлов обладают высокой щелочностью и используются в производстве стекла, керамики и щелочных батарей.
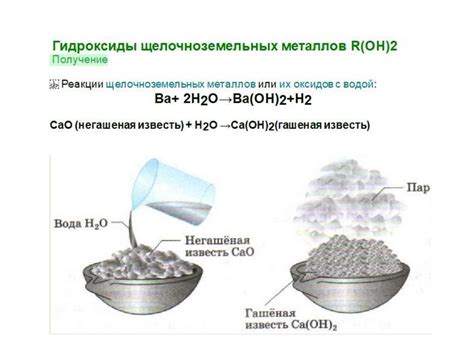
Вторую группу составляют гидроксиды, получаемые взаимодействием металлов с водой. Гидроксиды щелочноземельных металлов являются сильными основаниями и используются в качестве растворителей, а также в химической промышленности для нейтрализации кислотных растворов.
Еще одним важным классом соединений щелочноземельных металлов являются соли. Соли щелочноземельных металлов широко используются в производстве удобрений, пищевой промышленности, а также в медицине и фармацевтике. Они обладают высокой стабильностью и хорошей растворимостью в воде, что делает их удобными для использования в различных отраслях.
Каждое соединение щелочноземельных металлов имеет свои уникальные химические и физические свойства, которые определяют его применение и важность в различных отраслях. Изучение этих свойств позволяет лучше понять химию и использование щелочноземельных металлов в промышленности.
Соединения щелочноземельных металлов
Щелочноземельные металлы – это элементы периодической таблицы, расположенные второй группе. Их химические свойства промежуточны между щелочными металлами и металлами переходной группы. Щелочноземельные металлы образуют различные соединения, которые обладают интересными свойствами.
Одним из наиболее распространенных соединений щелочноземельных металлов является оксид. Оксиды щелочноземельных металлов имеют кристаллическую структуру и обладают высокой температурой плавления. Они образуют щелочные растворы, которые имеют щелочную реакцию и используются в различных отраслях промышленности.
Еще одним важным классом соединений щелочноземельных металлов являются соли. Соли щелочноземельных металлов обладают хорошей растворимостью в воде и образуют множество кристаллических соединений. Они широко применяются в химической промышленности, в производстве удобрений и в различных других областях.
Также щелочноземельные металлы образуют соединения с галогенами, серой, фосфором и другими элементами. Эти соединения обладают различными свойствами и широко применяются в синтезе органических соединений, в промышленности и в научных исследованиях.
Основные свойства щелочноземельных металлов

1. Атомные свойства:
Щелочноземельные металлы являются элементами периодической системы, располагающимися во второй группе. У них относительно небольшой радиус атома, который увеличивается от верхушки группы к ее основанию. Все щелочноземельные металлы имеют два электрона на внешней энергетической оболочке.
2. Физические свойства:
Щелочноземельные металлы обладают характеристиками, которые делают их уникальными. Они имеют низкую плотность, мягкость и низкую температуру плавления. Они также обладают металлическим блеском и способностью проводить тепло и электричество.
3. Химические свойства:
Щелочноземельные металлы достаточно активны и способны реагировать с различными веществами. Они реагируют с водой, образуя гидроксиды и выделяя водород. Они также образуют соединения с кислородом, серой, галогенами и многими другими элементами.
4. Реактивность:
Реактивность щелочноземельных металлов увеличивается от верхушки группы к ее основанию. Кальций, стронций и барий реагируют с водой, в то время как магний и бериллий не реагируют с водой, но могут реагировать с кислородом.
5. Влияние на живые организмы:
Щелочноземельные металлы играют важную роль в жизни организмов. Магний, кальций и стронций, например, необходимы для поддержания здоровья костей и зубов. Бериллий, в свою очередь, может быть ядовитым при вдыхании его пыли или попадании в организм.
| Элемент | Плотность (г/см³) | Температура плавления (°C) | Реакция с водой |
|---|---|---|---|
| Бериллий | 1.85 | 1278 | Не реагирует |
| Магний | 1.74 | 650 | Реагирует |
| Кальций | 1.54 | 842 | Реагирует |
| Стронций | 2.63 | 769 | Реагирует |
| Барий | 3.62 | 727 | Реагирует |
Таблица соединений щелочноземельных металлов

Щелочноземельные металлы, такие как бериллий, магний, кальций, стронций, барий и радий, образуют различные соединения с другими элементами. В таблице ниже представлены некоторые из этих соединений и их основные свойства.
| Металл | Соединение | Свойства |
|---|---|---|
| Бериллий | Бериллий оксид (BeO) | Твердое вещество, жаростойкое, химически стабильное, используется в высокотехнологичной промышленности. |
| Магний | Магний сульфат (MgSO4) | Белые кристаллы, хорошо растворимые в воде, используется в медицине и сельском хозяйстве. |
| Кальций | Кальций карбонат (CaCO3) | Белый порошок, нерастворим в воде, используется в производстве цемента, стекла и керамики. |
| Стронций | Стронций оксид (SrO) | Белый порошок, растворим в воде, используется в производстве стекла и электроники. |
| Барий | Барий хлорид (BaCl2) | Белые кристаллы, хорошо растворимые в воде, используется в медицине и радиологии. |
| Радий | Радий хлорид (RaCl2) | Радиоактивное соединение, используется в ядерной медицине и исследованиях. |
Эти соединения щелочноземельных металлов имеют различные применения, как в промышленности, так и в науке и медицине. Изучение их свойств и взаимодействий является важной частью химических исследований и разработок.
Химические свойства соединений щелочноземельных металлов

Соединения щелочноземельных металлов обладают рядом уникальных химических свойств, влияющих на их поведение в различных реакциях и применение в различных областях.
Одним из наиболее важных химических свойств щелочноземельных металлов является их способность образовывать ионы положительной заряды. Эти ионы могут образовывать соединения с анионами отрицательной заряды, такими как оксиды, гидроксиды и хлориды. Это делает щелочноземельные металлы полезными в качестве катализаторов, а также материалов для производства сплавов и других химических соединений.
Соединения щелочноземельных металлов также обладают высокой химической активностью и реактивностью. Они способны взаимодействовать с различными веществами и претерпевать разнообразные реакции, такие как окисление, обмен и осаждение. Это позволяет использовать их в процессах синтеза органических соединений и производстве различных промышленных продуктов.
Важным свойством щелочноземельных металлов и их соединений является их способность образовывать яркие пламенные реакции. Благодаря этому свойству щелочноземельные металлы часто используются в фейерверках, пиротехнике и других подобных мероприятиях для создания ярких световых эффектов.
Стоит отметить также, что химические свойства соединений щелочноземельных металлов могут варьироваться в зависимости от конкретного металла и его окружающей среды. Например, бериллий обладает особой стойкостью к кислороду и окислению, что делает его незаменимым материалом в промышленности, в то время как магний обладает способностью растворяться во многих кислотах, что используется в производстве лекарственных препаратов и других полезных продуктов.
Применение соединений щелочноземельных металлов
Соединения щелочноземельных металлов имеют широкое применение в различных отраслях науки и техники благодаря своим уникальным свойствам.
Применение в металлургии. Магний, кальций и стронций широко используются в металлургической промышленности для производства легких сплавов с повышенной прочностью и стойкостью к коррозии. Кальциевые и стронциевые соединения также применяются в процессах обработки стали и чугуна, что позволяет улучшить их механические свойства.
Применение в электронике. Барий и стронций используются в качестве материалов для производства электронных компонентов, таких как керамические конденсаторы, пьезоэлектрические датчики и CRT-мониторы. Эти металлы обладают высокой электропроводностью и теплопроводностью, что делает их идеальными материалами для использования в электронике.
Применение в химической промышленности. Барий и стронций активно применяются в производстве различных химических соединений. Барий используется для получения бариевых солей, которые используются в качестве добавок в нефтяной промышленности для улучшения свойств буровых растворов. Стронций находит применение в производстве стронция карбонацина, который используется как добавка в стекле и красках.
Применение в медицине. Кальций и магний являются важными элементами для поддержания здоровья человека. Кальций не только строительный материал для костей и зубов, но и участвует в множестве биохимических реакций в организме. Магний также необходим для нормальной работы сердечно-сосудистой системы. Благодаря этому, соединения этих металлов широко применяются в производстве лекарственных препаратов.
Применение в сельском хозяйстве. Магний и кальций являются важными микроэлементами для растений. Они участвуют в процессах фотосинтеза и синтеза белков, а также способствуют нормальному развитию корневой системы. Фертилизация почвы соединениями щелочноземельных металлов помогает улучшить урожайность и качество сельскохозяйственных культур.
Вопрос-ответ

Какие основные соединения составляют таблицу щелочноземельных металлов?
Основные соединения, входящие в таблицу щелочноземельных металлов, включают оксиды (например, оксид кальция CaO и оксид магния MgO), гидроксиды (например, гидроксид бария Ba(OH)2 и гидроксид стронция Sr(OH)2), карбиды (например, карбид кальция CaC2 и карбид стронция SrC2) и сульфиды (например, сульфид бария BaS и сульфид магния MgS).
Какие свойства характерны для соединений щелочноземельных металлов?
Соединения щелочноземельных металлов обладают рядом характерных свойств. Они обычно образуют белые или бесцветные кристаллы, обладают высокой температурой плавления и кипения, имеют высокую теплопроводность и теплоемкость. Кроме того, они растворяются в воде, образуя щелочные растворы, которые обладают щелочной реакцией.
Какие реакции образования происходят при взаимодействии щелочноземельных металлов с кислородом?
При взаимодействии щелочноземельных металлов с кислородом образуются соответствующие оксиды. Например, магний при взаимодействии с кислородом образует оксид магния (MgO), кальций - оксид кальция (CaO), барий - оксид бария (BaO) и так далее.
В чём заключается особенность гидроксидов щелочноземельных металлов?
Гидроксиды щелочноземельных металлов обладают щелочными свойствами и способны растворяться в воде с образованием гидроксид-ионов (например, ионов гидроксида OH-) и металлических катионов. Это делает гидроксиды щелочноземельных металлов важными промышленными и лабораторными реагентами.
