Оксиды щелочных металлов, таких как натрий, калий и литий, являются основными соединениями, обладающими рядом характерных реакций. Эти реакции связаны с их основными свойствами и способностью образовывать гидроксиды и соли.
Главной характеристикой оксидов щелочных металлов является их основная природа. Поэтому они обладают способностью вступать в реакции с кислотами, образуя соли. Эта реакция называется нейтрализационной реакцией и характеризуется выделением тепла и образованием воды.
Оксиды щелочных металлов также могут взаимодействовать с водой, образуя гидроксиды. Процесс этой реакции называется гидратацией и сопровождается образованием гидроксидов щелочных металлов. Эти гидроксиды обладают щелочными свойствами и используются в различных областях промышленности и научных исследований.
Важным аспектом реакций оксидов щелочных металлов является их растворимость в воде. Оксиды натрия и калия растворяются в воде с образованием щелочных растворов, которые широко используются в химической промышленности. Оксид лития, в свою очередь, малорастворим в воде, но образует гидроксид лития, который является высокорастворимым и обладает теми же свойствами, что и другие щелочные гидроксиды.
Химические свойства и реакции оксидов щелочных металлов
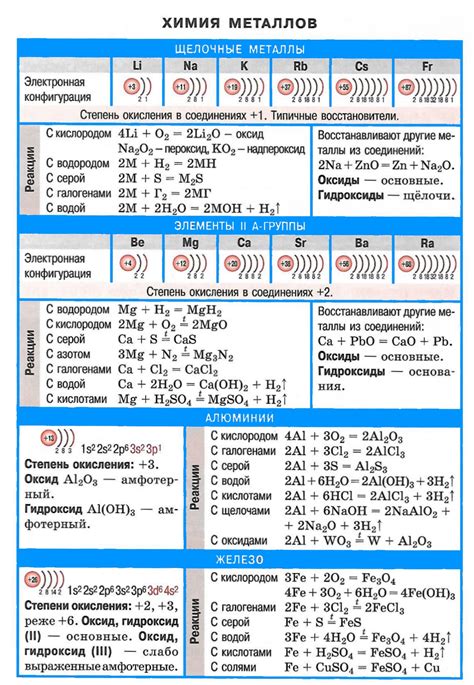
Оксиды щелочных металлов - это химические соединения, состоящие из кислорода и металла, принадлежащего к щелочным металлам. Они характеризуются реактивностью и обладают рядом химических свойств, которые делают их полезными в различных областях науки и промышленности.
Одной из основных реакций оксидов щелочных металлов является ионно-молекулярная реакция с водой. При контакте с водой оксиды щелочных металлов образуют гидроксиды и выделяются большие объемы теплоты. Эта реакция является экзотермической и сопровождается выделением водорода.
Оксиды щелочных металлов также реагируют с кислородом воздуха. При этом образуется пероксид металла, который обладает более высокой степенью окисления, чем исходный оксид. Данный процесс называется окислительной реакцией и обусловлен возможностью щелочных металлов приобретать различные степени окисления.
Оксиды щелочных металлов также взаимодействуют с кислотами, образуя соли щелочных металлов. Такие реакции называются нейтрализационными. При этом оксиды щелочных металлов выступают в качестве оснований, реагируя с протонами кислоты и образуя солевую связь.
Одной из интересных реакций оксидов щелочных металлов является их растворимость в воде. Оксиды лития и натрия хорошо растворяются в воде, при этом происходит образование гидроксидов, которые являются щелочными растворами. Оксиды калия, рубидия и цезия плохо растворяются в воде, образуя только малые количества гидроксидов.
Таким образом, химические свойства и реакции оксидов щелочных металлов определяют их применение в различных областях науки и технологии, включая производство стекла, электролитические процессы и другие промышленные процессы.
Реакция оксидов с водой

Щелочные металлы образуют оксиды, которые реагируют с водой, образуя гидроксиды и выделяя энергию. Реакция оксидов щелочных металлов с водой является экзотермической, что значит, что она сопровождается выделением тепла.
Вода в реакции с оксидом щелочного металла действует как легкодоступный ионный источник, который вызывает ионизацию оксида. Реакция происходит следующим образом:
- Оксид щелочного металла реагирует с водой.
- В результате реакции образуется гидроксид щелочного металла.
Например, реакция оксида натрия с водой:
- Na2O + H2O → 2NaOH
В данном случае оксид натрия реагирует с водой, образуя гидроксид натрия. Реакция сопровождается выделением тепла.
Другим примером может служить реакция оксида калия с водой:
- K2O + H2O → 2KOH
Также, подобные реакции протекают и с другими щелочными оксидами, такими как оксид лития (Li2O) и оксид рубидия (Rb2O).
Реакция оксидов щелочных металлов с водой является одной из основных реакций, которые можно наблюдать при изучении химических свойств оксидов щелочных металлов.
Реакция оксидов с кислотами
Оксиды щелочных металлов обладают основными свойствами и активно реагируют с кислотами. В ходе реакции оксиды образуют соли и воду. Это объясняется наличием в молекулах оксидов гидроксильной группы, которая растворяется в воде и может повторно реагировать с кислотами.
При взаимодействии оксидов с кислотами образуется соль и вода по общей схеме:
- Уравниваются уравнения оксидов и кислоты по количеству ионов вещества.
- Ионы гидроксильной группы из оксида реагируют с ионами водорода из кислоты, образуя молекулы воды.
- Образующиеся ионы металла и остатки кислоты соединяются, образуя соль.
- Уравновешивается получившееся химическое уравнение.
Например, рассмотрим реакцию оксида натрия (Na2O) с соляной кислотой (HCl):
| Вещество | Название |
|---|---|
| Na2O | Оксид натрия |
| HCl | Соляная кислота |
| NaCl | Хлорид натрия |
| H2O | Вода |
Уравнение реакции:
Na2O + 2HCl → 2NaCl + H2O
Таким образом, реакция оксидов щелочных металлов с кислотами является одним из способов получения солей и воды.
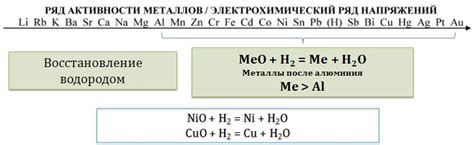
Реакция оксидов со средами окислительно-восстановительных реакций

Оксиды щелочных металлов – это соединения, которые образуются в результате соединения металла с кислородом. При взаимодействии сред окислительно-восстановительных реакций, оксиды щелочных металлов проявляют основные свойства, что связано с их химическим составом. Реакция оксидов с окислительными и восстановительными средами имеет определенные особенности и следует определенным закономерностям.
Первичной характеристикой оксида щелочного металла является его основность, то есть способность к образованию гидроксидов в результате реакции с водой. При взаимодействии оксида с окислительными соединениями, происходит образование различных продуктов, таких как окислительные или восстановительные вещества.
Реакция оксида щелочного металла с окислителем протекает с образованием основного гидроксида и выделением кислорода. Это является результатом перехода кислорода из оксида к окислителю, который проявляет свои окислительные свойства. При этом щелочной металл выступает в качестве восстановителя. В результате такой реакции образуется гидроксид щелочного металла и кислород, который выделяется в виде газа.
Взаимодействие оксидов щелочных металлов с восстановителем приводит к образованию металла и окисления восстановителя. В этом случае, оксид щелочного металла выступает в роли окислителя и способствует окислению восстановителя. Такая реакция приводит к образованию металла щелочного элемента и соединения, содержащего восстановитель.
Вопрос-ответ

Какие реакции могут происходить с оксидами щелочных металлов?
Оксиды щелочных металлов могут реагировать с водой, кислотами и некоторыми неорганическими соединениями. В результате таких реакций могут образовываться гидроксиды, соли или другие вещества.
Как происходит реакция оксида натрия с водой?
При контакте оксида натрия с водой происходит экзотермическая реакция, в результате которой образуется гидроксид натрия (щелочка) и выделяется большое количество тепла. Уравнение реакции: Na2O + H2O = 2NaOH.
Что происходит при реакции оксида калия с кислотой?
Оксид калия может реагировать с кислотами, образуя соответствующие соли и воду. Например, реакция оксида калия с соляной кислотой приводит к образованию хлорида калия и воды: K2O + 2HCl = 2KCl + H2O.
Может ли оксид лития реагировать с карбонатами?
Да, оксид лития может реагировать с карбонатами, образуя соответствующие соли и углекислый газ. Например, реакция оксида лития с натриевым карбонатом приводит к образованию карбоната лития и натрия: Li2O + Na2CO3 = Li2CO3 + Na2O.
Какие вещества могут образовываться при реакции оксида щелочного металла с аммиаком?
При реакции оксида щелочного металла с аммиаком образуются соответствующие гидроксид щелочного металла и соль аммония. Например, реакция оксида натрия с аммиаком приводит к образованию гидроксида натрия и аммония: Na2O + 2NH3 + H2O = 2NaOH + (NH4)2O.
