Одной из важнейших характеристик химических элементов является их способность взаимодействовать с другими веществами с образованием соединений. В современной химии особое внимание уделяется оксидам, которые представляют собой соединения элементов с кислородом. В зависимости от взаимодействия элементов с кислородом, оксиды делятся на кислотные, основные и амфотерные.
Металлы, образующие основные оксиды, являются кислотообразующими элементами. Основные оксиды образуются при прямом взаимодействии металлов с кислородом. В результате этого процесса образуется оксид металла, который проявляет щелочные свойства. Такие металлы как натрий, калий, кальций и магний обладают высокой активностью и способностью вступать в реакцию с кислородом даже при комнатной температуре.
Кислотообразующие элементы играют важную роль в различных процессах, включая синтез химических соединений и функционирование организмов. Они являются неотъемлемой частью химических реакций и обладают широким спектром применения в разных отраслях науки и техники.
Металлы, образующие основные оксиды
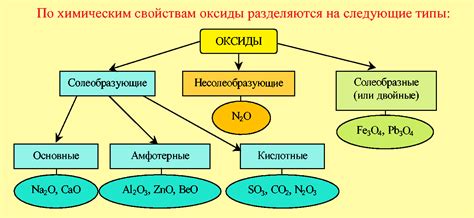
Основные оксиды, или основные оксиды металлов, - это соединения, образующиеся от взаимодействия кислорода с металлом. В результате этой реакции образуется оксид, который физически и химически проявляет щелочные свойства. Основные оксиды представляют из себя сильные основания и широко используются в различных областях.
В таблице Менделеева металлы, образующие основные оксиды, расположены в левой части периодической системы. Это калий, натрий, цезий, рубидий, кальций, стронций и барий. Они образуют основные оксиды сформулированных веществ: K2O, Na2O, Cs2O, Rb2O, CaO, SrO и BaO соответственно.
Основные оксиды свободно растворяются в воде, образуя гидроксиды металлов, которые также являются щелочами. Например, оксид калия K2O реагирует с водой и образует гидроксид калия KOH.
- Калий (K) - важный элемент в металлургии, используется для производства удобрений, стекла и других химических соединений.
- Натрий (Na) - используется как консервант в пищевой промышленности, при производстве стекла и многих других областях.
- Цезий (Cs) - применяется в научных исследованиях, в технологии производства электродов и в термоэлектрике.
- Рубидий (Rb) - используется для создания фоточувствительных элементов в оптике и солнечных панелях.
- Кальций (Ca) - находит применение в строительстве, медицине, производстве сплавов и в процессах очистки воды.
- Стронций (Sr) - применяется в производстве красителей, пиротехнических смесей и как компонент в сплавах.
- Барий (Ba) - используется в медицине, при производстве стекла и катализаторов, а также для защиты от рентгеновского излучения.
Металлы, образующие основные оксиды, играют важную роль в различных отраслях нашей жизни, обеспечивая нам удобства и прогресс в научно-технической сфере.
Кислотообразующие элементы
Металлы, образующие основные оксиды, являются кислотообразующими элементами. Кислотообразующие элементы – это элементы, которые образуют кислоты при сочетании с кислородом или другими элементами. Эти элементы характеризуются способностью образовывать соединения с высокой кислотностью и проявлять кислотные свойства.
Кислотность образуемых соединений определяется их способностью отдавать протоны (водородные ионы). Кислотной называется вода с произвольным кислотообразующим элементом, которая может отдавать протоны в растворе, образуя водородные ионы (H+). Кислотообразующие элементы входят в состав многих неорганических соединений, таких как оксиды, гидроксиды и соли.
Примерами кислотообразующих элементов являются металлы из группы 1 (щелочные металлы) и группы 2 (щелочноземельные металлы) периодической системы элементов. Щелочные металлы, такие как натрий, калий и литий, образуют основные оксиды и гидроксиды, которые обладают кислотообразующими свойствами.
Кислотообразующие элементы играют важную роль в химических реакциях и находят широкое применение в промышленности и научных исследованиях. Они используются для производства различных продуктов, включая лекарственные препараты, химические реагенты, удобрения и многие другие вещества.
Основные оксиды и их свойства
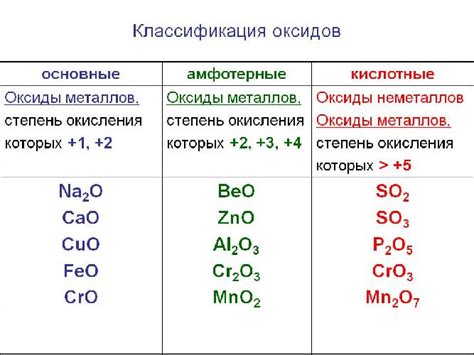
Основные оксиды – это химические соединения элементов, которые образуются при соединении металлов с кислородом. В результате такого соединения образуется основа (щелочь).
Основные оксиды обладают некоторыми характерными свойствами:
- Щелочная реакция: основные оксиды образуют растворы с щелочной реакцией, то есть они увеличивают концентрацию гидроксидного иона OH- в водных растворах.
- Образование основ: основные оксиды растворяются в воде с образованием щелочи, так как реагируют с водой, образуя гидроксиды. Эта реакция физически проявляется как реакция гидратации оксида.
- Твёрдые вещества: основные оксиды обычно являются твёрдыми веществами с высокой температурой плавления.
- Химическая активность: основные оксиды обладают высокой химической активностью, так как они готовы реагировать с водой, кислотами и другими веществами.
В качестве примеров основных оксидов можно привести оксиды металлов, таких как натрия, калия, магния и кальция. Они обладают указанными выше свойствами и широко используются в различных отраслях промышленности.
Также следует отметить, что основные оксиды являются кислотообразующими элементами, так как они растворяются в воде с образованием основ, что противоположно свойствам кислотных оксидов, которые реагируют с водой с образованием кислот.
Вопрос-ответ

Какова связь между металлами и образованием основы?
Металлы, образующие основные оксиды, являются кислотообразующими элементами, поскольку взаимодействуя с водой, они образуют основы. Это происходит благодаря тому, что основные оксиды металлов растворяются в воде, образуя гидроксиды – основы.
Какие металлы образуют основные оксиды?
Основными оксидами называются оксиды, которые растворяются в воде и образуют основания - щелочи. Таким образом, металлы, образующие основные оксиды, могут реагировать с водой и образовывать основания. Примерами таких металлов являются натрий, калий, магний, кальций, железо и др.
