Оксиды металлов – это специфический класс химических соединений, которые образуются при взаимодействии металлических элементов с кислородом. Эти соединения различаются по своим свойствам и способностям взаимодействия с другими веществами. Исследование оксидов металлов играет важную роль в химии и материаловедении.
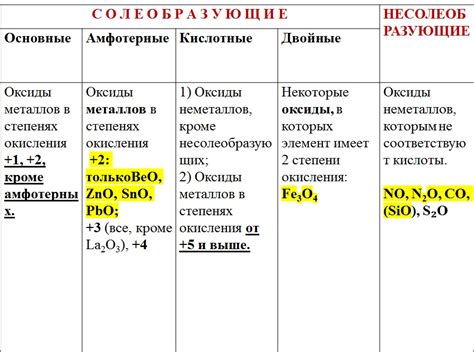
В зависимости от своих физико-химических свойств, оксиды металлов могут быть кислотными, основными или нейтральными. Кислотные оксиды обладают кислотной реакцией и способны растворяться в воде с образованием кислоты. Основные оксиды, в свою очередь, проявляют щелочные свойства и растворяются в воде с образованием щелочи. Нейтральные оксиды не проявляют ни кислотных, ни щелочных свойств и образуют нейтральные растворы.
Важно отметить, что характер оксида металла зависит от его окислительного состояния. Например, железо может образовывать оксиды с различной степенью окисления, такие как FeO, Fe2O3 и Fe3O4. Каждый из этих оксидов имеет разный характер и способность образования соединений с другими веществами.
Свойства и разнообразие оксидов металлов
Оксиды металлов - это соединения, состоящие из металлического элемента и кислорода. Они обладают разнообразными свойствами, которые зависят от химического состава и структуры оксида, а также от свойств самого металла.
Первое свойство, на которое следует обратить внимание, – физическое состояние. Некоторые оксиды металлов являются газами, например, оксид азота или оксид серы. Другие оксиды металлов – твердые вещества, например, оксид кальция или оксид алюминия. Также можно встретить оксиды, которые обладают жидким или пастообразным состоянием.
Кроме того, свойства оксидов металлов зависят от их электрохимической активности. Некоторые оксиды сильно реактивны и могут взаимодействовать с водой или кислотами, выделяя кислород. Другие оксиды металлов являются инертными и не обладают такой активностью.
Также следует отметить, что некоторые оксиды обладают кислотными свойствами, то есть они могут реагировать с щелочами и образовывать соли. Другие оксиды – щелочные, то есть они могут реагировать с кислотами, образуя соли. Также есть оксиды, которые не реагируют ни с кислотами, ни с щелочами и называются амфотерными.
Таким образом, оксиды металлов обладают разнообразными свойствами, представляющими интерес для изучения химии и применения в различных областях науки и промышленности.
Какие бывают оксиды металлов и их основные виды
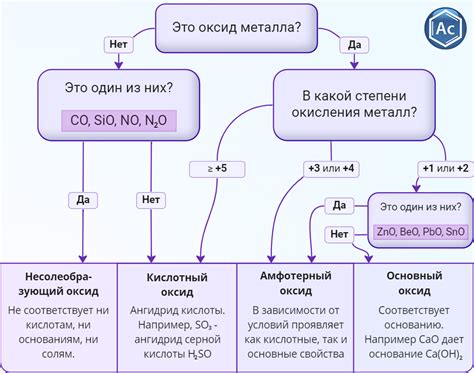
Оксиды металлов представляют собой химические соединения, состоящие из кислорода и одного или нескольких металлов. В зависимости от валентности металла и количества кислорода в соединении, оксиды металлов могут быть различными по своим свойствам и применению. Основными видами оксидов металлов являются анионные, катионные и нейтральные оксиды.
Анионные оксиды представляют собой соединения, в которых кислород имеет отрицательный заряд, а металл положительный. Эти оксиды обычно обладают щелочными свойствами и растворяются в воде, образуя гидроксиды. Примером анионных оксидов являются оксиды натрия и калия.
Катионные оксиды, наоборот, содержат положительно заряженный кислород и отрицательно заряженный металл. Эти оксиды обычно обладают кислотными свойствами и растворяются в воде, образуя кислоты. Примером катионных оксидов являются оксиды алюминия и железа.
Нейтральные оксиды, как следует из их названия, не обладают ни щелочными, ни кислотными свойствами. Вода не взаимодействует с нейтральными оксидами и они в целом не активны химически. Примером нейтральных оксидов являются оксиды металлов переходных элементов, таких как оксид железа (III) и оксид меди (II).
Однако, оксиды металлов могут обладать и другими свойствами, например, катализатором реакций, проводником электричества или обладать специфическими физическими свойствами. Каждый вид оксидов металлов имеет свои особенности и применение, что делает их важными в различных сферах науки и промышленности.
Роль оксидов металлов в естественном окружении
Оксиды металлов играют важную роль в естественном окружении и оказывают значительное влияние на различные процессы и явления. Эти химические соединения являются одним из самых распространенных классов соединений в земной коре и встречаются во многих природных материалах.
Во-первых, оксиды металлов являются основными компонентами рудных месторождений. Например, оксид железа (Fe2O3), также известный как гематит, является одним из самых распространенных минералов, из которого получают железо. Оксиды металлов также являются основными составными частями других рудных минералов, таких как оксид алюминия (Al2O3) в бокситах и оксид титана (TiO2) в ильмените.
Во-вторых, оксиды металлов играют важную роль в геохимических процессах и циклах веществ в природе. Например, оксиды железа участвуют в цикле железа, который включает окисление и восстановление железа в различных окружающих средах. Этот процесс влияет на качество воды в природных и искусственных системах.
Кроме того, оксиды металлов могут играть важную роль в образовании почвы и ее свойствах. Например, оксиды алюминия и железа являются основными компонентами глин, которые придают почве свойства удерживать влагу и питательные вещества для растений.
Таким образом, оксиды металлов имеют значительное значение в природе, определяя свойства материалов, участвуя в циклах веществ и влияя на различные геохимические процессы. Изучение и понимание их роли в естественных системах является важной задачей для ученых и специалистов в области геологии и окружающей среды.
Процессы образования оксидов металлов в промышленности
В промышленности процессы образования оксидов металлов являются важной составляющей различных производственных циклов. Они представляют собой необходимый этап для получения многих металлических компонентов и материалов.
Одним из основных процессов образования оксидов металлов является окисление металлов при взаимодействии с кислородом воздуха или водородом. Под воздействием высоких температур и каталитических факторов, металлы вступают в химическую реакцию с кислородом или водородом, при этом образуя оксиды металлов.
Наиболее распространенными методами формирования оксидов металлов в промышленности являются:
- Термическое окисление – процесс, при котором металл нагревается до определенной температуры для вызывания реакции с окружающим веществом и образования оксида металла.
- Электролитическое окисление – процесс, в ходе которого металлический предмет погружается в электролитическую среду, что приводит к окислению поверхностного слоя металла.
- Химическое осаждение – метод, при котором металл осаждается из раствора на поверхность других предметов, образуя оксид металла.
Формирование оксидов металлов может использоваться для создания различных материалов с уникальными свойствами. Оксиды металлов широко применяются в производстве керамики, стекла, электроники, металлургии и других отраслях промышленности. Каждый вид оксида металла обладает своими особыми химическими и физическими свойствами, что позволяет использовать их в различных технологических процессах.
Физические свойства оксидов металлов

Оксиды металлов – это химические соединения, состоящие из металлического элемента и кислорода. Они обладают рядом физических свойств, которые определяют их свойства и применение.
Первое физическое свойство оксидов металлов – это их цвет. Оксиды металлов могут иметь разнообразные оттенки, включая белые, желтые, черные, красные и синие. Цвет оксида зависит от его структуры и степени окисления металла.
Другое важное физическое свойство оксидов металлов – это их плотность. Оксиды металлов обычно обладают высокой плотностью, что делает их твердыми веществами при комнатной температуре. Однако некоторые оксиды, такие как оксид алюминия, могут быть пористыми и иметь меньшую плотность.
Еще одно важное физическое свойство оксидов металлов – это их температура плавления. Оксиды металлов обычно имеют высокую температуру плавления, что делает их стабильными и стойкими при высоких температурах. Это позволяет использовать оксиды металлов в различных технических и промышленных процессах.
Кроме того, оксиды металлов часто обладают электрической проводимостью. Некоторые оксиды металлов, такие как оксид меди или оксид железа, могут быть электропроводными и применяются в электронике и электротехнике.
Таким образом, физические свойства оксидов металлов играют важную роль в их использовании в различных областях, таких как промышленность, электроника и строительство. Знание этих свойств позволяет разработать новые материалы и улучшить существующие технологии.
Химические свойства оксидов металлов
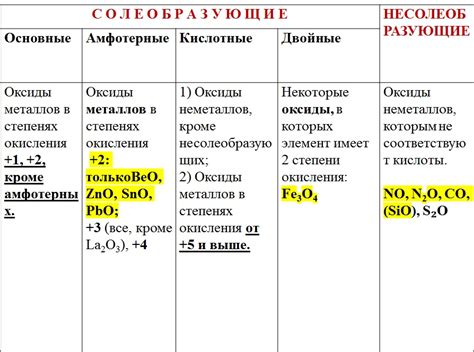
Оксиды металлов представляют собой соединения металлов с кислородом. Они обладают различными химическими свойствами, в зависимости от конкретного металла и степени окисления.
Оксиды металлов могут проявлять свойства оснований или кислот. Они могут реагировать с водой и образовывать растворы с щелочной реакцией. Это свойство характерно для щелочных и щелочноземельных металлов, таких как натрий, калий, магний и кальций. При реакции с водой оксиды этих металлов образуют гидроксиды, которые легко растворяются в воде.
Некоторые оксиды металлов могут также образовывать кислоты. Это свойство присуще металлам, таким как алюминий, железо и медь. Они реагируют с водой, образуя кислотные растворы, которые обладают кислотными свойствами.
Оксиды металлов могут быть также катализаторами в различных химических реакциях. Они используются в промышленности для получения различных продуктов, таких как кислоты, сплавы и другие соединения.
Некоторые оксиды металлов имеют катализаторы, которые способны ускорять химические реакции, не участвуя в них напрямую. Такие катализаторы играют важную роль в процессах синтеза и превращения неорганических и органических соединений.
Применение оксидов металлов в различных отраслях промышленности

Оксиды металлов широко используются в различных отраслях промышленности благодаря своим уникальным свойствам и широкому спектру применения.
В строительной отрасли оксиды металлов используются для производства строительных материалов, таких как кирпич, плиты и керамическая плитка. Например, оксид железа добавляется в цемент для придания ему красочных свойств и повышения прочности. Оксиды алюминия и кремния используются для создания огнеупорных материалов, которые используются в высокотемпературных процессах.
В электронной отрасли оксиды металлов используются для производства полупроводниковых материалов. Так, оксид цинка применяется в производстве светодиодов и солнечных батарей, а оксид кремния - для создания солнечных панелей. Оксиды меди, кобальта и других металлов используются в производстве магнитов и электронных компонентов.
Оксиды металлов также активно применяются в химической промышленности. Например, оксид кальция используется при производстве цемента, хлорида железа - как катализатор в процессах синтеза химических веществ. Оксид алюминия используется в качестве катализатора при производстве пластмасс и резиновых изделий.
Оксиды металлов также находят применение в пищевой промышленности. Оксид кремния добавляют в пищевые продукты для того, чтобы предотвратить их склеивание и улучшить текстуру. Оксид железа и цинка добавляют в продукты для придания им красочности. Оксид титана используется в качестве консерванта для продленного срока хранения пищевых продуктов.
Также оксиды металлов находят применение в медицине. Оксид цинка используется для лечения ран и ожогов, так как обладает противовоспалительными и антимикробными свойствами. Оксид железа используется в производстве железосодержащих препаратов, которые применяются при лечении анемии.
Вредность и опасность оксидов металлов для человека и окружающей среды

Оксиды металлов – химические соединения, состоящие из металла и кислорода. Они могут быть как природными, так и искусственно созданными. В зависимости от способа образования и состава оксиды металлов могут быть различными, но их вредность и опасность для человека и окружающей среды в значительной степени сходна.
Одним из наиболее известных и опасных оксидов металлов является оксид свинца (PbO). Этот оксид формируется при сгорании свинца и его соединений, и входит в состав вредных веществ. Вдыхание паров и пыли оксида свинца может вызвать отравление, влияющее на центральную нервную систему, печень, почки и другие органы. Кроме того, оксид свинца является канцерогеном и может вызвать раковые заболевания.
Токсичность оксидов металлов также связана с их способностью аккумулироваться в природной среде и биологических объектах. Например, оксид кадмия (CdO) обладает высокой токсичностью и способностью накапливаться в почках, печени и других органах человека, что может привести к хроническим заболеваниям и отравлениям.
Кроме того, оксиды металлов могут токсично воздействовать на окружающую среду, включая воду, почву и атмосферу. Их выбросы в атмосферу в результате промышленных процессов могут приводить к загрязнению воздуха и образованию смога. Оксиды металлов также могут попадать в воду и почву, что негативно сказывается на травах, деревьях, растениях и всем экосистеме в целом.
Для предотвращения негативного влияния оксидов металлов на человека и окружающую среду необходимо соблюдать меры безопасности при работе с металлическими материалами, избегать выбросов оксидов в атмосферу и следить за сохранностью природных ресурсов.
Способы предотвращения негативного воздействия оксидов металлов

Оксиды металлов - это химические соединения, получаемые при взаимодействии металлов с кислородом. Некоторые оксиды металлов могут оказывать негативное воздействие на окружающую среду и здоровье человека. Однако, существуют способы предотвращения этого негативного воздействия.
Во-первых, одним из способов предотвращения негативного воздействия оксидов металлов является контроль их выбросов в атмосферу. Для этого используются системы очистки газовых выбросов, которые позволяют удалить оксиды металлов из отходящих газов. Также важным мероприятием является регуляция выбросов оксидов металлов со стороны производственных предприятий.
Во-вторых, для предотвращения негативного воздействия оксидов металлов возможно использование различных методов обезвреживания. Например, оксиды металлов могут быть обработаны с помощью химических веществ, которые превращают их в менее опасные соединения. Также, возможны методы рециклинга металлических отходов, которые позволяют избежать образования новых оксидов металлов.
В-третьих, одним из способов предотвращения негативного воздействия оксидов металлов является применение современных технологий производства. Например, использование закрытых систем циркуляции веществ позволяет минимизировать выбросы оксидов металлов в окружающую среду. Также важным мероприятием является разработка и применение более эффективных катализаторов, способных уменьшить образование оксидов металлов в процессе производства.
Таким образом, предотвращение негативного воздействия оксидов металлов требует комплексного подхода, включающего контроль выбросов, применение методов обезвреживания и использование современных технологий производства. Это позволит минимизировать отрицательное воздействие оксидов металлов на окружающую среду и здоровье людей.
Вопрос-ответ

Какие свойства обладают оксиды металлов?
Оксиды металлов обладают рядом характерных свойств: они являются кислотными, щелочными или амфотерными соединениями, способными реагировать с водой, кислородом и другими веществами. Они также обладают высокой температурой плавления и кипения, металлическим блеском и проводимостью тепла и электричества.
Что такое амфотерность оксидов металлов?
Амфотерность оксидов металлов - это их способность проявлять как кислотные, так и щелочные свойства. Такие оксиды могут взаимодействовать как с кислотами, образуя соли, так и с основаниями, образуя гидроксиды. Примеры амфотерных оксидов: оксид алюминия (Al₂O₃) и оксид свинца (PbO).
Как оксиды металлов реагируют с водой?
Оксиды металлов могут реагировать с водой, образуя соответствующие гидроксиды. Эта реакция может быть экзотермической или эндотермической, в зависимости от свойств оксида и условий реакции. Некоторые оксиды реагируют с водой очень быстро и взрывоопасно, например, натриевый и калиевый оксиды (Na₂O и K₂O), в то время как другие металлические оксиды реагируют очень медленно или вообще не реагируют.
Какая связь между оксидами металлов и их электроным строением?
Оксиды металлов образуются при взаимодействии металлов с кислородом. В процессе образования оксида металл отдает электроны кислороду, образуя положительные ионы металла (катионы), а кислород получает электроны, образуя отрицательные ионы кислорода (анионы). Таким образом, зарядовое состояние оксида металла зависит от его электронного строения и способности отдавать или принимать электроны.
