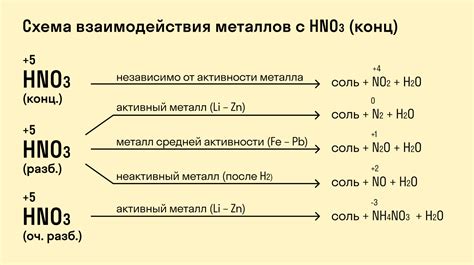
Кислоты являются незаменимым инструментом в химической промышленности и лабораторных исследованиях. Однако, при взаимодействии с металлами они могут вызывать изменения в их свойствах и структуре. Понимание этих взаимодействий имеет важное значение для различных областей науки и технологий, таких как металлургия, коррозионная защита и синтез новых материалов.
Одним из наиболее изученных аспектов взаимодействия кислот с металлами является процесс коррозии. Коррозия – это процесс разрушения металлов под воздействием окружающей среды. Кислоты усиливают этот процесс, образуя электрохимические ячейки на поверхности металла, что ведет к его разрушению. Понимание механизмов и закономерностей коррозии позволяет разработать эффективные меры по защите металлов от коррозии и продлить их срок службы.
Кроме этого, кислоты могут использоваться для изменения структуры металлов. Это особенно важно в металлургии и синтезе новых материалов. Кислоты могут применяться для разложения соединений металла и удаления нежелательных примесей. Они также могут использоваться для формирования поверхностных покрытий с помощью процессов электроосаждения или химического осаждения. Эти методы позволяют получить материалы с особыми свойствами, такими как повышенная твердость, износостойкость или декоративность.
Воздействие кислот на свойства металлов
Металлы подвержены воздействию кислот, которое может приводить к изменению их свойств и структуры. Кислоты обладают способностью реагировать с поверхностью металла, вызывая растворение, коррозию или другие химические изменения.
При взаимодействии с кислотой, металлическая поверхность может производиться образование газов, осадков или изменение цвета. Например, агрессивные кислоты, такие как серная или азотная, могут вызывать сильную коррозию, подвергая металл деградации и ухудшению его механических свойств.
Некоторые металлы, такие как алюминий или цинк, могут реагировать с сильными кислотами, образуя соединения, которые не растворяются в воде. Например, реакция алюминия с серной кислотой приводит к образованию сульфата алюминия, который можно использовать, например, в процессе очистки воды.
Кроме того, некоторые кислоты, такие как уксусная или соляная, могут применяться для удаления оксидов или нежелательных загрязнений с поверхности металла. Эти кислоты обладают раздражающим эффектом и требуют аккуратного использования, чтобы избежать повреждений металлической поверхности.
Таким образом, воздействие кислот на металлы может иметь как положительные, так и отрицательные эффекты. Использование кислот для обработки металлов требует тщательного контроля и знаний о химическом взаимодействии, чтобы достичь желаемых результатов без повреждения материала.
Химическое взаимодействие металлов с кислотами

Химическое взаимодействие металлов с кислотами является одной из основных реакций, которые происходят между ними. Металлы могут реагировать с различными кислотами, включая сильные и слабые кислоты.
Взаимодействие происходит путем образования ионов металла и ионов водорода при разрыве связей в кислоте. В зависимости от свойств металла и кислоты, реакция может протекать различными способами и иметь разную интенсивность.
Образование ионов металла в реакции с кислотами может приводить к образованию солей металла, которые обладают определенными свойствами. Некоторые металлы могут растворяться в кислотах, образуя ионно-молекулярные соединения и выделяя водород.
Реакция металлов с кислотами может сопровождаться эффектами, такими как выделение газов, изменение цвета раствора, образование осадков или изменение pH среды. Такие явления могут быть использованы для идентификации металлов и кислот в химических реакциях.
Важно отметить, что химическое взаимодействие металлов с кислотами может приводить к изменению свойств и структуры металла, что имеет значение в промышленных и научных приложениях.
Коррозия металлов под действием кислот
Коррозия металлов является одной из основных проблем, с которыми сталкиваются инженеры и производители. Один из основных факторов, вызывающих коррозию, это воздействие кислот на металлические поверхности.
Коррозия металлов под действием кислот происходит из-за химических реакций между металлом и кислотой. Кислота может реагировать с поверхностью металла, образуя растворимые соли и ионы металла, которые затем могут даже проникнуть внутрь металла, вызывая его разрушение.
Скорость коррозии зависит от многих факторов, включая вид кислоты, концентрацию, температуру и длительность воздействия. Некоторые кислоты, такие как сольфатная и соляная, очень агрессивны и способны вызывать интенсивную коррозию металлов уже при низких концентрациях.
Некоторые металлы более устойчивы к коррозии под действием кислот, чем другие. Например, нержавеющая сталь обладает высокой степенью стойкости к большинству кислот, благодаря наличию защитной пленки оксида на поверхности. Однако, некоторые кислоты, такие как азотная или фтороводородная, могут атаковать даже нержавеющую сталь.
Для защиты металлов от коррозии под действием кислот применяют различные методы, такие как нанесение защитных покрытий, использование антикоррозионных жиров, контроль концентрации кислоты и регулярное обслуживание оборудования. Эти меры помогают увеличить срок службы металлов и сохранить их работоспособность.
Влияние кислот на физические свойства металлов
Кислоты могут оказывать существенное влияние на физические свойства металлов. Взаимодействие металлов с кислотами может приводить к изменению их структуры и микроструктуры, а также физическим свойствам.
Одним из основных физических свойств металлов, которое может изменяться под воздействием кислот, является их термическая стабильность. Кислоты способны вызывать коррозию металлов, что приводит к изменению их термического поведения и ухудшению их стабильности при высоких температурах.
Кроме того, кислоты могут оказывать влияние на магнитные свойства металлов. Например, некоторые кислоты могут изменять магнитную восприимчивость металлов или приводить к появлению магнитных свойств у ранее немагнитных материалов.
Также кислоты могут влиять на электрические свойства металлов. Например, некоторые кислоты могут увеличивать электропроводность металлов или вызывать образование пленки оксида, что может приводить к изменению электрической проводимости металлов.
В целом, взаимодействие металлов с кислотами может приводить к изменению их физических свойств и обладать как положительными, так и отрицательными эффектами. Поэтому важно учитывать взаимодействие с кислотами при использовании металлов в различных отраслях промышленности и научных исследованиях.
Реакция металлов на различные типы кислот
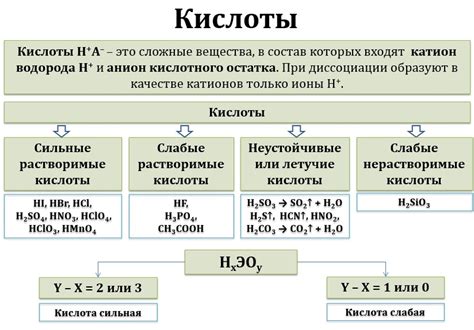
Взаимодействие металлов с кислотами является важным аспектом изучения их свойств. Кислоты могут оказывать различное воздействие на разные металлы, что определяется их типом и концентрацией.
Сильные минеральные кислоты, такие как серная, хлорная или азотная, проявляют высокую активность в отношении большинства металлов. Они вызывают окислительно-восстановительные реакции, в результате которых металлы могут растворяться, образуя соли и выделяя газы, например, водород.
Однако не все металлы одинаково реагируют на кислоты. Некоторые металлы, такие как золото или платина, не подвергаются коррозии под действием большинства кислот. Они считаются химически инертными и обладают высокой устойчивостью к окислительным процессам.
Другие металлы, например, цинк или алюминий, активно реагируют с кислотами и могут изнашиваться в процессе этой реакции. Они образуют соли, при этом может выделяться газ и происходить растворение металла. Такие реакции особенно интенсивны в присутствии концентрированных кислот.
Также важно отметить, что наиболее активные металлы, такие как натрий или калий, могут реагировать даже с водными растворами кислот. Они способны образовывать гидроксиды и выделять водородный газ, что свидетельствует о высокой реакционной способности этих металлов.
Электрохимические взаимодействия металлов с кислотами
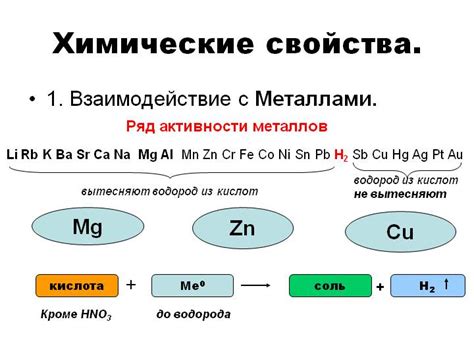
Электрохимические взаимодействия металлов с кислотами представляют собой важный аспект исследования свойств металлов. Кислоты могут вступать в реакцию с металлами, вызывая различные электрохимические процессы.
При взаимодействии металлов с кислотным раствором образуется водород, при этом происходит реакция окисления металла. Металлы, которые активно реагируют с кислотами, называются химически активными.
Интенсивность электрохимической реакции зависит от химической активности металла и концентрации кислоты. Чем больше концентрация кислоты, тем активнее протекает процесс образования водорода и окисления металла.
Некоторые металлы, такие как цинк и железо, способны реагировать с кислотами, образуя соответствующие соли и выделяя водород. Однако, некоторые металлы, например, золото и платина, не вступают в реакцию с кислотами и считаются химически инертными в отношении данных веществ.
Влияние концентрации кислот на свойства металлов
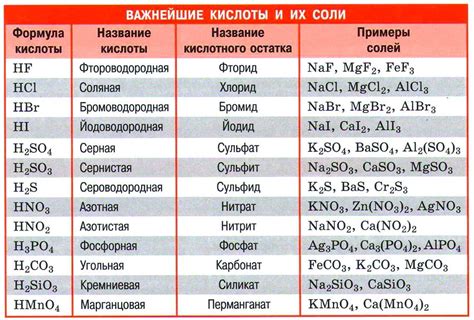
Концентрация кислоты является одним из основных факторов, влияющих на свойства металлов. Изменение концентрации кислоты может привести к значительным изменениям в микроструктуре и химическом состоянии поверхности металла.
Повышенная концентрация кислоты может вызвать коррозию металла, поскольку она способна разрушать защитные покрытия и образовывать активные ионы, способные атаковать металлическую поверхность. Коррозия может привести к образованию пузырьков, трещин и сквозных отверстий на поверхности металла, что снижает его механическую прочность и устойчивость к внешним воздействиям.
Однако, некоторые металлы могут быть устойчивы к определенным концентрациям кислоты и образованию коррозии. Например, алюминий и нержавеющая сталь образуют пассивную окисленную поверхность, которая защищает металл от дальнейшей коррозии при низких концентрациях кислоты. Однако, при повышенных концентрациях кислоты, защитная окисленная пленка может быть разрушена, что приведет к активной коррозии.
Концентрация кислоты также может влиять на процессы металлообработки, такие как травление и электрохимические обработки. При изменении концентрации кислоты можно контролировать глубину и равномерность травления металла. Например, повышенная концентрация кислоты может увеличить скорость травления, что может быть полезно при обработке металлов с большим количеством гравированных узоров или текстур.
- Повышенная концентрация кислоты может вызвать коррозию металла
- Некоторые металлы могут быть устойчивы к определенным концентрациям кислоты
- Концентрация кислоты может влиять на процессы металлообработки
Практическое применение взаимодействия кислот и металлов

Взаимодействие кислот с металлами имеет широкое практическое применение в различных сферах деятельности. Одним из основных применений является процесс очистки металлических поверхностей от загрязнений и коррозии. Кислоты, такие как серная, соляная, азотная и другие, используются для удаления окисленных слоев с поверхности металлов, восстановления их первоначального внешнего вида и обеспечения защиты от дальнейших повреждений.
Кислоты также применяются в металлургической промышленности для проведения ряда процессов, таких как выщелачивание руды, обработка металлических сплавов и получение металлов высокой чистоты. Например, серная кислота используется для выщелачивания меди из руды, а фторид водорода - для обработки алюминия. Эти процессы позволяют получать металлы определенного качества и характеристик, необходимых для различных отраслей промышленности.
Кислоты также широко применяются в процессе гальванического покрытия металлов. Этот процесс позволяет нанести на поверхность металла защитное покрытие или декоративное покрытие различных металлов. Например, при использовании соляной кислоты и цинка можно нанести на поверхность стали цинковое покрытие, которое защищает металл от коррозии.
Кислотное взаимодействие с металлами также используется в процессе получения водорода, как в лабораторных условиях, так и для промышленного использования. Взаимодействие соляной кислоты с металлами, такими как цинк или алюминий, приводит к выделению водорода и образованию соответствующих солей. Водород широко используется в различных отраслях промышленности, включая производство аммиака, водородного палива и водородные топливные элементы.
Вопрос-ответ

Что такое кислотное взаимодействие с металлами? Как оно происходит и какие реакции при этом могут происходить?
Кислотное взаимодействие с металлами - это процесс химической реакции между кислотой и металлическим веществом. При контакте кислоты с металлом обычно происходит образование солей и выделение газа - водорода. Реакция протекает по следующей схеме: металл + кислота -> соль + водород. Например, при взаимодействии соляной кислоты (HCl) с цинком (Zn) образуется хлорид цинка (ZnCl2) и выделяется водород (H2).
Какие металлы растворяются в кислотах? Есть ли металлы, которые не реагируют с кислотами и почему?
Реакция металлов с кислотами зависит от их электрохимической активности. Некоторые металлы, такие как натрий (Na), калий (K), железо (Fe) и алюминий (Al), реагируют с кислотами довольно активно и легко растворяются в них. Другие металлы, например, серебро (Ag), золото (Au) и платина (Pt), не реагируют с кислотами и не растворяются в них. Это связано с тем, что активные металлы имеют большую склонность к окислению, что позволяет им образовывать соли и выделять водород. Неактивные металлы не имеют достаточной электрохимической активности для взаимодействия с кислотами.
Какие металлы реагируют с кислотами очень активно и почему?
Некторые металлы реагируют с кислотами очень активно, так как они имеют высокую электрохимическую активность. К таким металлам относятся натрий (Na), калий (K), железо (Fe) и алюминий (Al). Они образуют стабильные соли и выделяют большое количество водорода при взаимодействии с кислотой. Это связано с тем, что эти металлы имеют низкую электрохимическую энергию и высокую склонность к окислению. Из-за этого они активно вступают в реакцию с кислотами.
