Окисление металлов - важный процесс в химии, который не только приводит к изменению электронного состояния металла, но и имеет большое значение в различных отраслях промышленности. Один из основных параметров, определяющих окислительно-восстановительные свойства металла, это его степень окисления.
Степень окисления - это число, которое показывает, сколько электронов металл отдал или принял при образовании ионов. В зависимости от количества отданных или принятых электронов, степень окисления может быть положительной, отрицательной или нулевой. Это позволяет классифицировать металлы и определить их реакционную способность.
Один из способов определить степень окисления металла - это анализ его химических свойств и взаимодействий с другими элементами. Некоторые металлы имеют фиксированную степень окисления, например, кальций всегда имеет степень окисления +2, алюминий всегда +3. Однако большинство металлов могут иметь разные степени окисления в зависимости от условий реакции.
Дефиниция степеней окисления

Степени окисления - это численные значения, которые указывают, сколько электронов металл отдал или принял при образовании соединения. Они помогают определить, насколько окислительные или восстановительные свойства имеет металл в данном соединении.
Степень окисления металла может быть положительной, отрицательной или равной нулю. Положительная степень окисления указывает на то, что металл потерял электроны и окислился, а отрицательная степень окисления говорит о том, что металл принял дополнительные электроны и восстановился.
Определение степени окисления металла зависит от его электроотрицательности и конкретного химического соединения. Например, в оксидах и ионах металлов, степень окисления равна заряду металла. В кислородных кислотах металлача степень окисления равна заряду металла, а в водородных кислотах степень окисления равна разности между зарядом металла и числом атомов водорода.
Чтобы определить степень окисления металла в сложных соединениях, нужно знать правила определения степени окисления и уметь учитывать их при анализе химической формулы. Используя эти знания, можно точно определить степень окисления металла и сделать выводы о его свойствах и поведении в соединении.
Окисление и восстановление
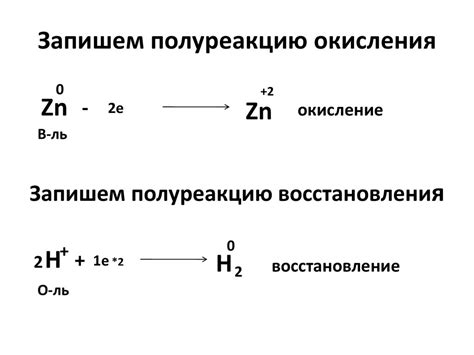
Окисление и восстановление являются важными процессами в химии, которые происходят между веществами при взаимодействии друг с другом. Окисление - это процесс, при котором вещество теряет электроны, а восстановление - наоборот, процесс получения электронов.
Окисление и восстановление происходят при реакциях окисления-восстановления, которые могут быть как химическими, так и электрохимическими. Часто такие реакции связаны с изменением степени окисления атомов, особенно металлов.
Металлы могут иметь различные степени окисления, которые указывают на количество электронов, участвующих в реакции окисления-восстановления. Например, железо может иметь степени окисления +2 и +3, что означает, что оно может отдать два или три электрона при окислении и принять соответственное количество электронов при восстановлении.
- Окисление металлов - это процесс, при котором атомы металла теряют электроны и повышают свою степень окисления.
- Восстановление металлов - это процесс, при котором атомы металла получают электроны и уменьшают свою степень окисления.
- Реакции окисления-восстановления между металлами и другими веществами позволяют получать различные продукты, а также играют важную роль в промышленности и химических процессах.
Реакции окисления-восстановления металлов также используются в электрохимических элементах, таких как аккумуляторы и гальванические элементы. Они позволяют преобразовывать химическую энергию в электрическую и наоборот. Понимание основных степеней окисления металлов позволяет учитывать эти процессы и использовать их в различных областях науки и техники.
Свойства окислителей

Окислители - вещества, способные вступать в реакцию с другими веществами, передавая им электроны. Их основные свойства:
- Агрессивность: окислители обладают способностью разлагать органические и неорганические соединения. Они могут вызывать коррозию и разрушение материалов.
- Энергоемкость: окислительные реакции сопровождаются выделением энергии. Взаимодействие окислителя с веществом протекает с выделением тепла или света.
- Высокая электроотрицательность: окислители имеют способность привлекать электроны к себе. В реакции окисления окислитель получает электроны от вещества, которое окисляется.
- Инертность по отношению к кислороду: окислители, как правило, сами не окисляются кислородом из воздуха и не окисляются водой. Они способны передавать кислород другим веществам.
Окислители широко используются в различных областях, например, в промышленности и химии. Они имеют значительное значение для синтеза химических соединений, производства энергии и многих других процессов.
Свойства восстановителей

Восстановители - это вещества, которые способны передавать электроны другим веществам, тем самым снижая степень окисления этих веществ. Они обладают одним или несколькими электронами лишними по сравнению с атомами вещества, которое они восстанавливают.
Основными свойствами восстановителей являются:
- Агрессивность. Восстановители обладают высокой активностью и способностью взаимодействовать с другими веществами, приводя к их окислению.
- Электронная способность. Восстановители обладают лишними электронами, которые они готовы отдать веществам с более высокой степенью окисления для устранения нежелательных процессов окисления.
- Реакционная способность. Восстановители могут взаимодействовать с различными веществами, образуя реакционные продукты, которые часто обладают новыми свойствами и могут быть использованы в химической промышленности.
- Влияние на окружающую среду. Восстановители могут оказывать влияние на окружающую среду, поэтому их использование требует строгого контроля и соблюдения правил безопасности.
Восстановители играют важную роль в химических реакциях, таких как процессы гальванической коррозии, электролиз, синтез органических соединений и многих других. Понимание свойств восстановителей позволяет контролировать и управлять этими процессами для достижения нужного результата.
Список основных степеней окисления металлов
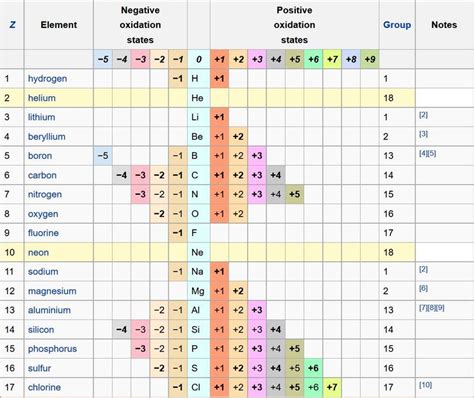
Степень окисления - это число, которое указывает, сколько электронов атом металла смог отдать или принять при образовании ионов. Основные степени окисления металлов могут быть положительными или отрицательными.
Некоторые основные степени окисления металлов:
- +1: литий, натрий, калий, рубидий, цезий;
- +2: бериллий, магний, кальций, стронций, барий;
- +3: бор, алюминий, галлий, индий, таллий;
- +4: титан, цирконий, германий, олово, свинец;
- +5: ванадий, ниобий, антимоний, бисмут, теллур;
- +6: хром, молибден, ураний, вольфрам, селен;
- +7: марганец, рений, технеций, рутений, осмий.
Также существуют металлы, у которых переменная степень окисления, например, железо может иметь степени окисления +2 и +3, медь - +1 и +2.
Вариативность степеней окисления

Вариативность степеней окисления является одной из характерных особенностей металлов. Она определяется способностью металлов образовывать различные оксиды, в которых степень окисления металла может быть разной.
Существует два типа вариативности степеней окисления: простая и сложная. В случае простой вариативности степени окисления металла может принимать только две различные значения, например, +1 и +2. Существуют также металлы, которые могут принимать три значения, например, +1, +2 и +3.
Сложная вариативность степеней окисления характерна для металлов, которые могут принимать больше двух значений степеней окисления. Например, у марганца существует 8 возможных степеней окисления: +2, +3, +4, +5, +6, +7, +8 и +12. Другим примером является ураний, который может принимать степени окисления от +3 до +6.
Вариативность степеней окисления металлов обусловлена различной электрохимической активностью металла и его способностью образовывать соединения с разным числом валентных электронов. Вариативность степеней окисления имеет большое значение при изучении свойств и реакций металлов, а также при синтезе и применении их соединений.
Роль степеней окисления в химических реакциях

Степени окисления металлов играют важную роль во множестве химических реакций. Они определяют, насколько атом металла окислен или восстановлен в процессе реакции. Знание степеней окисления помогает установить электронную переток во время окислительно-восстановительных реакций, которые являются основой всех химических превращений.
Во время окислительно-восстановительных реакций атомы металла могут переходить из одной степени окисления в другую, меняя свою электронную конфигурацию. Это связано с перетоком электронов между реагирующими веществами. Атомы металла, которые теряют электроны, считаются окисленными и имеют положительное значение степени окисления. Атомы металла, которые получают электроны, считаются восстановленными и имеют отрицательное значение степени окисления.
Знание степеней окисления металлов позволяет предсказывать химическую активность и возможные реакции металлов с другими веществами. Многие химические соединения образуются путем объединения атомов металлов с атомами неметаллов. При этом степени окисления могут изменяться, что указывает на происходящие в реакции окислительно-восстановительные процессы.
Степени окисления металлов также используются для нумерации химических соединений. Например, в названиях соединений содержится информация о степени окисления металла. Это позволяет полностью определить состав и свойства химического соединения по его названию.
Таким образом, степени окисления металлов играют важную роль в определении электронной структуры и химической активности металлов, а также в понимании и прогнозировании химических реакций, в которых они участвуют.
Применение степеней окисления в практике

Степени окисления металлов имеют широкое применение в различных областях практики. Например, они играют важную роль в химическом анализе и идентификации веществ. Зная степень окисления металла в соединении, можно определить его химическую активность и свойства.
Кроме того, степени окисления металлов используются в процессах электролиза, осаждения металла на поверхности другого металла и в процессах каталитических реакций. Знание степеней окисления металлов позволяет определить, какие соединения и условия будут наиболее эффективными для проведения определенной химической реакции.
Кроме того, степени окисления металлов играют важную роль в практике производства и использования различных материалов. Например, степень окисления металла в сплаве может влиять на его прочность, электропроводность и другие физические свойства. Поэтому при разработке новых материалов и сплавов учитывается степень окисления металлов, чтобы достичь требуемых характеристик материала.
В целом, знание основных степеней окисления металлов является важным инструментом для химиков, инженеров и других специалистов, работающих в области химии и материаловедения. Оно помогает понять и предсказать реакции и свойства веществ, а также разрабатывать новые материалы и процессы с использованием металлов.
Вопрос-ответ

Какие основные степени окисления металлов существуют?
Основные степени окисления металлов могут быть различными в зависимости от элемента. К примеру, у железа есть основные степени окисления +2 и +3, у меди - +1 и +2, у алюминия - +3 и +2. Такие степени окисления являются наиболее распространенными для данных элементов.
Какие электроны отдает металл при окислении?
Металл отдает электроны согласно основным степеням окисления. Например, железо в степени окисления +2 отдает 2 электрона, а в степени окисления +3 отдает 3 электрона.
Как основные степени окисления металлов связаны с окислительно-восстановительными реакциями?
Основные степени окисления металлов играют важную роль в окислительно-восстановительных реакциях. Металлы с более высокими степенями окисления (например, медь с +2 степенью окисления) могут выступать в качестве окислителя, при этом сами окисляются, тогда как металлы с более низкими степенями окисления (например, медь с +1 степенью окисления) могут выступать в качестве восстановителя, при этом сами восстанавливаются.
