Таблица Менделеева является основой для организации и систематизации всех известных химических элементов. В периоде таблицы Менделеева электронные оболочки всех элементов имеют одно и то же количество энергетических уровней, что позволяет проводить анализ и сравнение их химических свойств.
Одним из важнейших химических свойств элементов является их кислотность. Кислотность химических элементов зависит от их способности отдавать или принимать электроны при реакциях с другими веществами. В периоде таблицы Менделеева химические элементы изменяют свои кислотные свойства от галогенов к щелочным металлам.
Галогены, такие как фтор, хлор, бром и йод, расположены во втором периоде таблицы Менделеева и обладают выраженной кислотностью. Они могут отдавать электроны и образовывать кислоты при взаимодействии с основаниями. Например, раствор фтороводорода HF является кислотой, так как фтор отдает электроны и образует ион водорода.
Однако, по мере продвижения вниз по периоду таблицы Менделеева, кислотные свойства элементов становятся менее выраженными. Щелочные металлы, такие как литий, натрий, калий и др., расположены в первом периоде таблицы Менделеева и обладают щелочными свойствами. Они могут принимать электроны и образовывать основания при взаимодействии с кислотами. Например, раствор гидроксида натрия NaOH является щелочью, так как натрий принимает электрон от иона гидроксида.
Изменение кислотных свойств в периоде таблицы Менделеева

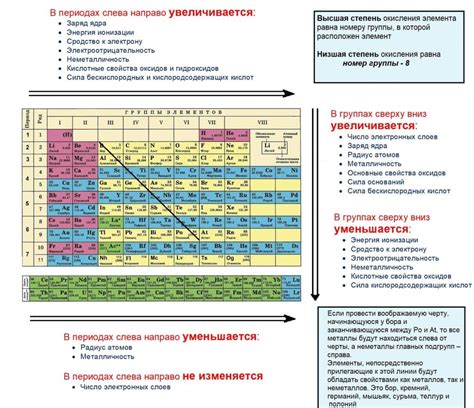
Кислотные свойства элементов меняются в периоде таблицы Менделеева в соответствии с изменением электронной структуры и электроотрицательности элементов. Электроотрицательность, как известно, увеличивается в периоде с лева на право. Это означает, что электроотрицательность увеличивается от металлов к неметаллам, отщелочных металлов к галогенам.
Наибольшее кислотное свойство проявляют галогены. Они легко вступают в реакцию с металлами, образуя соли. Как мы знаем, кислоты обычно вступают в реакцию с металлами, вытесняя из их соединений водород. Галогены также образуют оксокислоты с водородом и не металлами. Например, хлор образует водородную хлористую кислоту НСl, фтор — водородную фтористую кислоту НF, и так далее.
Наоборот, щелочные металлы, такие как литий, натрий и калий, обладают очень слабыми кислотными свойствами. Они образуют гидроксиды при реакции с водой, но водород не высвобождается из этих соединений. Щелочные металлы, на самом деле, демонстрируют свойства оснований, которые выражаются в образовании гидроксидов. Гидроксиды щелочных металлов обладают щелочными свойствами и используются в различных отраслях промышленности и бытовых нуждах.
Таким образом, можно сделать вывод, что в периоде таблицы Менделеева кислотные свойства элементов изменяются от галогенов к щелочным металлам, и это изменение связано с ростом электроотрицательности и изменением электронной структуры элементов.
От галогенов к щелочным металлам
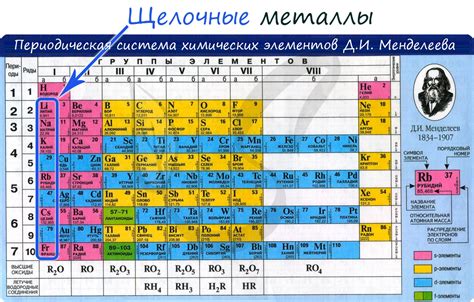
Галогены – это химическая группа элементов, которая включает фтор, хлор, бром, иод и астат. Они находятся в группе 17 (7А) периодической системы Менделеева и характеризуются высокой химической активностью. Галогены образуют сильные кислоты и обладают выраженными окислительными свойствами. Они образуют соли с щелочными металлами, такими как натрий и калий.
Галогены сильно реагируют с металлами и образуют ионные соединения, особенно с щелочными металлами. Например, хлор образует хлорид натрия (NaCl) и хлорид калия (KCl) – две наиболее известные соли в химии. Галогены также могут образовывать соединения с другими металлами, такими как цинк и железо, образуя соответствующие галогениды.
Щелочные металлы – это элементы из первой группы (1А) периодической системы Менделеева, включающие литий, натрий, калий, рубидий, цезий и франций. Они обладают низкой плотностью, малой температурой плавления и высокой реактивностью. Щелочные металлы образуют сильные основания и имеют щелочные окислительные свойства.
Щелочные металлы реагируют с водой, образуя гидроксиды – сильные щелочные растворы. Например, натрий образует гидроксид натрия (NaOH), который является основным компонентом многих бытовых моющих средств. Кроме того, щелочным металлам свойственно образование солей – ионных соединений с кислыми окислами не-металлов.
Изменение свойств в периоде

В периоде таблицы Менделеева свойства элементов изменяются по мере продвижения от галогенов к щелочным металлам. Галогены расположены во втором столбце периода и характеризуются высокой электроотрицательностью и способностью образовывать сильные кислоты.
Следующими в периоде идут элементы средней активности, а затем металлы и щелочные металлы. Эти элементы имеют меньшую электроотрицательность и обладают способностью образовывать основания, то есть вещества, способные принимать протоны.
Во второй половине периода таблицы Менделеева свойства элементов становятся все более металлическими. Металлы характеризуются высокой электропроводностью, блеском, способностью образовывать положительные ионы. Щелочные металлы – это элементы первой группы периода, которые обладают особенно выраженными металлическими свойствами.
Таким образом, в периоде таблицы Менделеева происходит изменение кислотных свойств: от галогенов, образующих сильные кислоты, к щелочным металлам, образующим основания.
Изменение кислотных свойств в периоде таблицы Менделеева: от галогенов к щелочным металлам
Кислотные свойства элементов в периоде таблицы Менделеева изменяются в зависимости от их положения в периоде и группе. Начиная с галогенов, которые находятся в седьмой группе, элементы проявляют высокую кислотность и могут образовывать кислотные соединения с другими элементами.
Галогены, такие как хлор, бром и йод, проявляют ярко выраженные кислотные свойства. Они образуют кислоты галогеноводородов (соответственно хлороводородную, бромоводородную и йодоводородную кислоты), которые легко растворяются в воде и отдают протон в реакциях с основаниями.
Переходя к щелочным металлам в первой группе, кислотные свойства существенно изменяются. Щелочные металлы, такие как литий, натрий и калий, проявляют выраженные щелочные свойства. Они образуют основания, которые легко растворяются в воде и принимают протоны от кислот. В реакциях с кислотами они образуют соли и воду.
Таким образом, свойства элементов в периоде таблицы Менделеева меняются от кислотных к щелочным по мере продвижения по группам. Галогены в седьмой группе проявляют кислотные свойства и образуют кислоты галогеноводородов, а щелочные металлы в первой группе, наоборот, образуют основания и проявляют щелочные свойства.
Вопрос-ответ

Зачем нужно изучать изменение кислотных свойств в периоде таблицы Менделеева?
Изучение изменения кислотных свойств в периоде таблицы Менделеева позволяет понять и объяснить ряд закономерностей и особенностей химических свойств элементов. Это помогает установить правила реакций, на основании которых можно предсказывать химическую активность различных элементов и их способность образовывать кислоты.
Как меняются кислотные свойства в периоде таблицы Менделеева?
В периоде таблицы Менделеева кислотные свойства элементов меняются по мере снижения электроотрицательности. Галогены, находящиеся в верхней части периода, обладают самыми высокими электроотрицательностями и сильно проявляют кислотные свойства, образуя кислоты при реакции с водой. По мере движения вниз по периоду, электроотрицательность уменьшается, а кислотные свойства становятся слабее, и в конце периода щелочные металлы почти не образуют кислоты.
Почему галогены обладают сильными кислотными свойствами?
Галогены обладают сильными кислотными свойствами из-за высокой электроотрицательности и возможности образования анионов. Они легко реагируют с водой, образуя кислоты и ион гидроксония. Более высокая электроотрицательность ведет к более сильным кислотным свойствам, поэтому галогены проявляются как сильные кислоты, особенно фтор.
