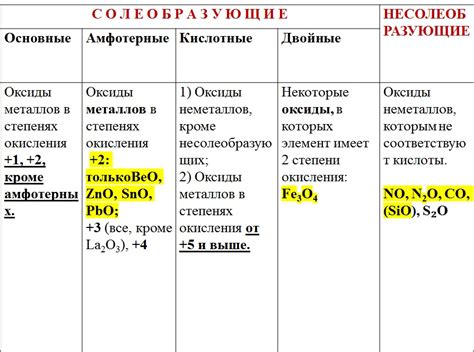
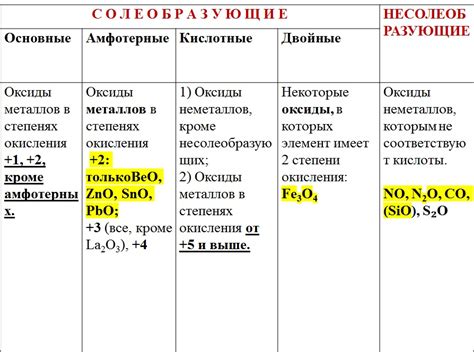
Оксиды металлов — это неорганические соединения, состоящие из атомов металла и кислорода. В природе встречается огромное количество оксидов различных металлов, которые изначально были получены в результате окисления металлов воздухом или другим окислителем. Общая формула оксидов металлов часто записывается как MO, где M представляет собой символ металла, а O — символ кислорода.
Оксиды металлов могут обладать различными свойствами в зависимости от их состава и структуры. Некоторые оксиды являются кислотными, то есть при реакции с водой образуют кислоты. Другие оксиды являются щелочными или амфотерными, что означает, что они могут реагировать и как кислоты, и как основания. Есть также нейтральные оксиды, которые не обладают кислотно-основными свойствами и не реагируют с водой.
Оксиды металлов имеют важное применение в различных областях, таких как металлургия, химическая промышленность, электроника и катализ. Они используются как сырье для производства металлов, керамики и стекла, а также в процессе получения электроэнергии и очистки отходов.
Структура оксидов металлов
Структура оксидов металлов определяется способом, в котором атомы металла и кислорода соединяются в молекуле или кристаллической решетке.
Оксиды металлов могут образовывать различные типы структур, такие как ионные, ковалентные или металлические.
Ионные оксиды, такие как оксид натрия или оксид кальция, образуются при реакции металлов с кислородом и имеют кристаллическую структуру, в которой ионы металла и кислородные ионы образуют упорядоченные решетки.
Ковалентные оксиды, такие как оксид углерода (двуокись углерода), имеют структуру, в которой атомы кислорода и металла связаны ковалентными связями.
Металлические оксиды, такие как оксид железа или оксид магния, имеют структуру, в которой металлические атомы образуют металлическую решетку, а атомы кислорода заполняют промежутки в этой решетке.
Структура оксидов металлов влияет на их физические и химические свойства, такие как плотность, температура плавления, растворимость и способность реагировать с другими веществами.
Ковалентная структура оксидов металлов

Оксиды металлов могут образовывать ковалентные соединения, где связи между атомами образуются за счет обмена электронами. В таких соединениях между атомами металла и кислорода обычно присутствуют двухцентровые и многоточечные связи.
Ковалентная структура оксидов металлов может быть представлена в виде сети, где каждый атом оксигена связан с несколькими атомами металла. Это позволяет образованию оксидов металлов различных структур, включая молекулярные, согласованно-коваралентные и полимерные.
В случае молекулярных оксидов, атомы металла и кислорода соединяются в молекулы, где каждый атом металла связан с несколькими атомами кислорода. Примером молекулярного оксида может служить диоксид серы (SO2), где атомы серы связаны с двумя атомами кислорода.
Согласованно-коваралентные оксиды также имеют ковалентную структуру, но в них каждый атом металла связан с несколькими атомами кислорода, а также с другими атомами металла. Примером согласованно-коваралентного оксида может служить трехокись арсеника (As2O3), где атомы арсеника связаны как с кислородом, так и друг с другом.
Полимерные оксиды образуются при соединении большого числа атомов металла и кислорода в трехмерные структуры. В таких соединениях каждый атом металла связан с несколькими атомами кислорода, и структура оксида образует полимерную цепь или сетку. Например, оксид кремния (SiO2) образует полимерную сетку из атомов кремния и кислорода.
Все эти различные структуры оксидов металлов обусловлены различными энергетическими и электростатическими условиями формирования соединения, а также химическими свойствами металла и кислорода.
Ионная структура оксидов металлов

Оксиды металлов представляют собой химические соединения, состоящие из атомов металла и кислорода. При рассмотрении структуры оксидов металлов можно выделить ионную структуру, связанную с ионными связями между атомами кислорода и металла.
Ионная структура оксидов металлов характеризуется тем, что в ней присутствуют положительно заряженные ионы металла и отрицательно заряженные ионы кислорода. Атомы кислорода образуют анионы, привязанные к иону металла. Такая структура обуславливает высокую степень электроотрицательности оксидов металлов.
Ионная структура оксидов металлов может быть представлена в виде решетки, где ионы металла занимают позиции большего радиуса, а ионы кислорода расположены ближе к центру решетки. Эта структура придает оксиду металла определенные свойства, такие как прочность и твердость.
Важно отметить, что ионная структура оксидов металлов может варьироваться в зависимости от вида металла и его окислительных свойств. Некоторые оксиды металлов могут образовывать простые ионные решетки, а другие могут обладать более сложной структурой, включающей полимерные цепи или слои.
Таким образом, ионная структура оксидов металлов играет важную роль в их химических свойствах и определяет их реакционную способность и использование в различных областях науки и промышленности.
Свойства оксидов металлов
1. Физические свойства:
Оксиды металлов могут иметь различные физические свойства в зависимости от типа металла и степени окисления. Некоторые оксиды представляют собой кристаллические твёрдые вещества, другие - аморфные порошки. Оксиды могут быть как нерастворимыми в воде, так и растворимыми в различных средах.
2. Химические свойства:
Оксиды металлов образуются при соединении металлов с кислородом и проявляют химическую активность в зависимости от своей структуры и степени окисления. Некоторые оксиды обладают щелочными свойствами, то есть они реагируют с водой, образуя гидроксиды металлов. Другие оксиды являются амфотерными, что означает, что они могут взаимодействовать как с кислотами, так и с основаниями. В то же время существуют оксиды, которые проявляют кислотные свойства, т.е. они реагируют с основаниями, образуя соли металлов.
3. Роль в природе:
Оксиды металлов широко распространены в земной коре и играют важную роль в различных природных процессах. Например, оксид железа (Fe2O3) является основным компонентом ржавчины и оксида алюминия (Al2O3) - основным компонентом бокситов, из которых добывают алюминий. Оксиды металлов также могут быть использованы как катализаторы в химических реакциях и материалы для создания специальных свойств в различных областях науки и промышленности.
Вопрос-ответ

Какие общие формулы можно выделить для оксидов металлов?
Для оксидов металлов можно выделить несколько общих формул, в зависимости от степени окисления металла. Например, для оксидов с максимальной степенью окисления формула имеет вид MO, где M - металл. Для оксидов с меньшей степенью окисления формулы могут быть более сложными, например, M2O3 или M3O4.
Какие формулы могут иметь оксиды металлов с разной степенью окисления?
Оксиды металлов могут иметь разные формулы в зависимости от степени окисления металла. Оксиды с максимальной степенью окисления имеют формулу MO. Оксиды с меньшей степенью окисления могут иметь формулы, такие как M2O3 или M3O4. Некоторые металлы могут образовывать оксиды с разными степенями окисления в зависимости от условий реакции и окружающей среды.
