Реакция металла с ортофосфорной кислотой представляет собой химический процесс, в результате которого металл вступает в реакцию с ортофосфорной кислотой, образуя сложные соединения и выделяяся водород. Эта реакция изучается и важна в химии, так как она позволяет получить продукты с определенными свойствами и применяется в различных процессах, включая синтез соединений и использование металла в промышленности.
Механизм реакции металла с ортофосфорной кислотой базируется на взаимодействии активного металла с кислотой, которая является протонным донором. Во время реакции между металлом и ортофосфорной кислотой происходит передача протона от кислоты к металлу, что приводит к образованию ионов металла и фосфат-ионов. Выделение пузырьков водорода является результатом образования газообразных продуктов реакции.
Реакция металла с ортофосфорной кислотой может происходить с различной интенсивностью в зависимости от физических и химических свойств металла. Некоторые металлы, такие как натрий и калий, реагируют быстро и сильно с ортофосфорной кислотой, что сопровождается выделением большого количества водорода и активным образованием фосфат-ионов. Другие металлы, такие как железо и медь, реагируют медленнее и слабее, образуя меньшее количество газа и соединений.
Основные свойства реакции металла с ортофосфорной кислотой включают образование огненной сферы вокруг места контакта металла и кислоты, выделение тепла и света, а также возможность использования полученных продуктов в различных промышленных процессах. Кроме того, реакция может быть использована для определения содержания металла в образце, так как интенсивность реакции зависит от количества металла и его активности.
Механизм реакции металла с ортофосфорной кислотой

Реакция металла с ортофосфорной кислотой является типичным примером реакции замещения, которая происходит между металлом и кислотой. Механизм этой реакции включает несколько стадий.
На первой стадии происходит протонирование металла кислотой. В результате этой реакции образуется ион металла, который приходит в активное состояние и готов к дальнейшим взаимодействиям.
На второй стадии ион металла реагирует с ортофосфорной кислотой, образуя соединение металла с фосфорной кислотой. В результате этой реакции образуется пентавалентный ион фосфата.
На третьей стадии ион фосфата реагирует с водой, образуя восстановленную ортофосфорную кислоту и ион гидроксида. Это является регенерацией кислоты и завершением реакции.
Важно отметить, что механизм реакции металла с ортофосфорной кислотой может зависеть от типа металла, его активности и условий реакции. Некоторые металлы могут образовывать растворимые соли, в то время как другие могут образовывать нерастворимые осадки.
Реакция металла с ортофосфорной кислотой обладает рядом важных свойств. Во-первых, она может быть использована для получения различных соединений металла с фосфорной кислотой, которые имеют широкий спектр применений, начиная от промышленности до лабораторных исследований. Во-вторых, эта реакция может быть использована для определения содержания металла в образце. Например, путем измерения образовавшегося осадка или иона, можно определить количество металла в растворе.
Ортофосфорная кислота: свойства и особенности

Ортофосфорная кислота – химическое соединение, также известное как фосфорная кислота или H3PO4. Она представляет собой бесцветную жидкость с характерным сильным запахом.
Свойства ортофосфорной кислоты обусловлены ее химическим строением. Она является трехосновной кислотой, то есть одну молекулу кислоты можно принять тремя молекулами натрия, калия или других щелочных металлов.
Ортофосфорная кислота является сильным окислителем и реагентом, образуя разнообразные соединения с металлами и неметаллами. Она обладает коррозионными свойствами и может агрессивно взаимодействовать с железными поверхностями.
Ортофосфорная кислота находит применение в различных отраслях промышленности, в том числе в производстве удобрений, фосфатных солей, химических реактивов и пищевых добавок.
Особенности реакции металла с ортофосфорной кислотой заключаются в том, что в результате взаимодействия поверхности металла с кислотой образуется газ, который может быть обнаружен по выделению пузырьков или изменению цвета раствора. Данная реакция может происходить с выделением тепла, обусловленным химическими превращениями веществ.
Таблица ниже приводит примеры реакций различных металлов с ортофосфорной кислотой:
| Металл | Радиальное возбуждение |
|---|---|
| Марганец (Mn) | Розовый |
| Железо (Fe) | Оранжевый |
| Цинк (Zn) | Синий |
Эти примеры демонстрируют, что в результате реакции металлов с ортофосфорной кислотой происходит изменение цвета раствора и выделение соответствующего газа.
Реакция металла с ортофосфорной кислотой: основные этапы
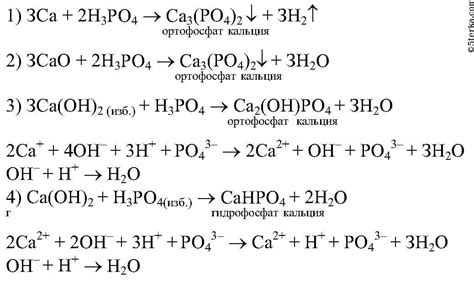
1. Активация кислоты: При начале реакции ортофосфорная кислота (H3PO4) проявляет свои кислотные свойства. Она диссоциирует на ионы водорода (H+) и ионы фосфата (PO43-). Эти ионы соединяются с ионами металла, образуя соли.
2. Образование соли: Металл вступает в реакцию с ортофосфорной кислотой, образуя соль и выделяя молекулы воды. Формула соли зависит от металла и может быть указана в виде 2NaPO4 или Mg3(PO4)2, где Na и Mg обозначают соответствующие металлы.
3. Выделение воды: В процессе образования соли от кислой среды выделяются молекулы воды. Это связано с тем, что металл принимает ион водорода (H+), а молекула воды H2O получается в результате реакции между ионом водорода и ионами гидроксила (OH-), которые присутствуют в ортофосфорной кислоте.
4. Возможность обратной реакции: Однако реакция металла с ортофосфорной кислотой может протекать в обратном направлении. Если соль металла уже существует, то при добавлении воды она может разлагаться на металл и ортофосфорную кислоту.
Таким образом, реакция металла с ортофосфорной кислотой включает несколько этапов, начиная с активации кислоты и образования соли, а заканчивая выделением воды и возможностью обратной реакции.
Металлы, реагирующие с ортофосфорной кислотой
Ортофосфорная кислота, также известная как фосфорная(V) кислота, является одним из наиболее распространенных и химически активных соединений фосфора. Эта кислота образует специфические реакции с различными металлами, в результате которых образуются фосфористые соединения.
Один из наиболее известных примеров реакции ортофосфорной кислоты с металлами – это реакция с алюминием. В результате этой реакции образуется солевой комплекс – алюминий дифосфат, который представляет собой белый кристаллический порошок. Этот соль используется в различных областях, включая производство керамики и стекла, а также как добавка в пищевую промышленность.
Еще один пример реакции ортофосфорной кислоты с металлами – это реакция с цинком. При реакции цинка с ортофосфорной кислотой образуется фосфат цинка, которые также имеет широкое применение, в том числе в производстве минеральных удобрений.
Реакция ортофосфорной кислоты с другими металлами, такими как железо, магний, натрий и кальций, также проявляет сходные свойства. В зависимости от условий реакции и концентрации кислоты, образуются различные фосфаты, которые могут быть использованы в различных отраслях промышленности.
Взаимодействие металла с ортофосфорной кислотой: химические превращения

Взаимодействие металла с ортофосфорной кислотой происходит при соприкосновении этих двух веществ, в результате чего происходят химические превращения. Ортофосфорная кислота действует как окислитель, вызывая окисление металла.
В ходе реакции между металлом и ортофосфорной кислотой происходит выделение газа – фосфористого водорода. Этот газ имеет характерный запах и обладает ядовитыми свойствами. Взаимодействие металла с ортофосфорной кислотой происходит с выделением тепла и является экзотермическим процессом.
Образовавшийся при реакции соли металла принято называть фосфатами. Фосфаты обладают различными свойствами и находят широкое применение в различных областях, включая сельское хозяйство, медицину и промышленность.
Ортофосфорная кислота является сильной кислотой и может вызвать ожоги при контакте с кожей, поэтому необходимо соблюдать меры безопасности при работе с ней. Также важно помнить о том, что реакция металла с ортофосфорной кислотой может протекать с различной интенсивностью в зависимости от свойств и концентрации используемых веществ, поэтому необходимо проявлять осторожность и соблюдать соответствующие протоколы и рекомендации при проведении таких экспериментов.
Физические свойства реагентов и продуктов реакции
Ортофосфорная кислота (также известная как фосфорная кислота) представляет собой бесцветную или желтоватую, вязкую жидкость с характерным запахом. Ее плотность составляет около 1,88 г/см³, а температура плавления составляет около 42,35 °C. Кислотность ортофосфорной кислоты высока, она может вызывать ожоги и раздражение при контакте с кожей и слизистыми оболочками.
Металлы, в свою очередь, имеют различные физические свойства в зависимости от своего химического состава и структуры. Некоторые металлы (например, натрий или калий) являются мягкими и легко реагируют с ортофосфорной кислотой. Другие металлы (например, алюминий или железо) могут реагировать с ортофосфорной кислотой, но не так активно.
В результате реакции металла с ортофосфорной кислотой, образуется фосфид металла. Фосфиды металлов обычно имеют вид порошка или кристаллов, их цвет может варьироваться от желто-коричневого до черного. Фосфиды металлов обладают высокой температурной стабильностью и могут быть пирофорными - способными воспламеняться при контакте с воздухом.
Практическое применение реакции металла с ортофосфорной кислотой

Реакция металла с ортофосфорной кислотой имеет широкое практическое применение в различных областях науки и промышленности. В частности, данная реакция широко используется в химическом анализе для определения содержания металлов в различных образцах.
Одним из основных применений этой реакции является получение фосфатов, которые широко используются в сельском хозяйстве как удобрения. Реакция металла с ортофосфорной кислотой позволяет получить фосфатные соли, которые содержат необходимые для растений питательные элементы. Таким образом, данная реакция играет важнейшую роль в повышении урожайности и качества сельскохозяйственных культур.
Кроме того, реакция металла с ортофосфорной кислотой используется в производстве различных химических соединений, таких как промышленные кислоты, соли, катализаторы и др. Это связано с тем, что фосфатные соединения обладают широкими химическими и физико-химическими свойствами, которые позволяют использовать их в различных процессах.
В области электрохимии реакция металла с ортофосфорной кислотой также находит свое применение. Например, она может быть использована для получения электрохимически активных материалов, которые применяются в производстве аккумуляторов и электродов.
Вопрос-ответ

Какая реакция происходит между металлом и ортофосфорной кислотой?
Реакция металла с ортофосфорной кислотой является реакцией образования соли. Металл замещает водород в кислоте, образуя фосфатную соль металла и выделяя водородный газ.
Какие свойства имеет ортофосфорная кислота?
Ортофосфорная кислота (H3PO4) - это кислота средней силы, широко используемая в промышленности и научных исследованиях. Она имеет жидкую форму и без цвета, обладает высокой вязкостью и сильным химическим влиянием. Ортофосфорная кислота образует соли, о подробностях реакции с металлами чуть ниже.
Каков механизм реакции металла с ортофосфорной кислотой?
Механизм реакции металла с ортофосфорной кислотой включает замещение водорода в кислоте металлом. Водород и металл образуют водородные ионы и ионы металла, а кислота образует фосфатные ионы. Таким образом, металл реагирует с ортофосфорной кислотой, образуя фосфатную соль и выделяя водородный газ.
