Опыты являются незаменимым инструментом в процессе обучения химии. Интересно, когда наши ученики смогут провести удивительные эксперименты, развивая свои навыки и интерес к науке. В этой статье мы рассмотрим несколько увлекательных опытов с щелочными металлами, которые подходят для учеников 9 класса.
Первый опыт, который мы предлагаем, называется "Реакция металла с водой". Для этого опыта понадобятся небольшие кусочки щелочного металла, таких как натрий или калий, и вода. Ученик должен аккуратно положить кусочек металла в небольшую посудину с водой, дожидаясь реакции. При взаимодействии металла с водой происходит выделение водорода и образование гидроксида щелочного металла. Ученикам будет интересно наблюдать за процессом и понимать его химическую суть.
Еще один интересный опыт называется "Реакция щелочного металла с кислотой". В данном случае, ученикам потребуется небольшое количество щелочного металла, такого как литий или натрий, и разбавленная соляная кислота. Ученики должны аккуратно положить кусочек металла в стакан с кислотой и наблюдать за реакцией. В результате происходит образование соли и выделение водорода. Этот опыт поможет ученикам углубить свои знания о реакциях между щелочными металлами и кислотами.
Интересные опыты с щелочными металлами являются прекрасной возможностью для учеников 9 класса познакомиться с основными химическими реакциями и закономерностями. Они помогут ученикам развить творческое мышление и интерес к науке, а также позволят им провести время с пользой и удовольствием.
Эффектные опыты с калием

Калий — металл из щелочных металлов, который можно использовать для проведения интересных химических опытов. Несмотря на то, что калий является очень реактивным элементом, его свойства можно испытать в безопасной обстановке. Вот несколько эффектных опытов с калием, которые могут быть проведены учениками 9 класса.
1. Реакция калия с водой
Один из самых известных опытов с калием - это его реакция с водой. При контакте с водой, калий начинает интенсивно гореть. В результате возникает яркий пламень, а также образуется щелочной раствор. Этот опыт можно провести в специальной колбе с водой под контролем учителя.
2. Реакция калия с хлором
Калий также реагирует с хлором, образуя белый порошок хлорида калия. Этот опыт можно провести, поместив кусочек калия в стеклянную колбу и добавив капли хлора. Реакция проходит с выделением тепла и образованием непрозрачного вещества.
3. Калий и воздух
Калий реагирует с кислородом воздуха, образуя окисел калия (калийную пятиокись). Эта реакция также сопровождается интенсивным сгоранием и выделением тепла. Опыт можно провести, поместив кусочек калия на небольшую площадку, а затем поджигая его с помощью спички. Образуется яркий оранжевый огонь и образ светлого порошка.
4. Реакция калия с серной кислотой
Калий прекрасно реагирует с различными кислотами, в том числе и с серной. При этом образуется сульфат калия и выделяется газ диоксид серы. Опыт можно провести, положив небольшой кусочек калия в колбу с серной кислотой. Реакция сопровождается выделением газа и наблюдением плавающей на поверхности колбы желтой облака.
Все эти опыты с калием могут помочь учащимся лучше понять его химические свойства и знакомят с особенностями проведения реакций с реактивными металлами.
Удивительные свойства натрия

Натрий – это один из очень интересных щелочных металлов, обладающий рядом удивительных и полезных свойств. Он относится к активным элементам и быстро реагирует с водой, выделяя запах, зажигаясь и образуя гидроксид натрия.
Реакция натрия с водой: когда натрий помещается в воду, происходит взрывоопасная реакция с выделением водорода. Одна капля воды, налитая на кусочек натрия, вызовет громкий хлопок и высвобождение яркого пламени.
Влияние натрия на краситель: еще одним интересным свойством натрия является его влияние на красители. Если добавить натрий в баночку с моющим средством и попытаться смешать, то цвет моющего средства изменится.
Изучение ионов натрия: ионы натрия – это положительно заряженные частицы, которые играют важную роль в регуляции водно-солевого баланса в организме человека. Познакомиться с ними можно, используя довольно простую химическую реакцию.
Применение натрия в быту: натрий имеет широкое применение в быту. Гидроксид натрия (натр) используется в производстве мыла, стекла, бытовой химии. Кроме того, соду – источник натрия – часто используют в кулинарии для разрыхления теста, а также для снятия запаха и пятен.
Необычные реакции лития
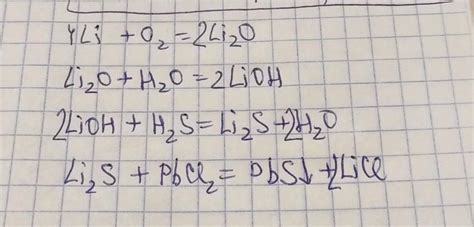
Литий - это щелочной металл, который при взаимодействии с различными веществами проявляет необычные реакции. Одна из таких реакций наблюдается при соединении лития с водой. Под воздействием воды литий активно взаимодействует, выбрасывая из себя пузырьки водорода и оставляя на поверхности воды остатки гидроксида лития.
Взаимодействие лития с кислородом также вызывает интересные явления. При нагревании лития в присутствии кислорода образуется яркое пламя, окрашенное в красный цвет. Это связано с реакцией лития с кислородом, при которой образуется оксид лития. При большом количестве кислорода реакция может стать взрывоопасной.
Еще одной интересной особенностью лития является его способность к взаимодействию с аммиаком. При этой реакции происходит образование амидолития, который обладает свойствами сильного основания. Амидолитий, в свою очередь, может использоваться для получения органических соединений, таких как амиды и аминолитий.
Также литий способен реагировать с многими кислотами, образуя соли. Например, реакция лития с соляной кислотой приводит к образованию хлорида лития. Данная реакция может сопровождаться выделением газа, что делает ее еще более интересной для наблюдения.
В целом, реакции лития с различными веществами проявляют его активность и химическую реактивность. Изучение этих реакций позволяет ученикам углубить свои знания о свойствах щелочных металлов и развить интерес к химии.
Интересные эксперименты с рубидием

Рубидий – это щелочной металл, который широко используется в научных исследованиях и обладает необычными свойствами. Вот несколько интересных экспериментов, которые можно провести с рубидием и которые будут интересны учащимся 9 класса.
1. Эксперимент с горением рубидия
Для этого эксперимента потребуется помещение с низким уровнем освещенности и безопасной поверхностью, например, темная комната или специальный пламеустойчивый столик.
1. Берем маленький кусочек рубидия и нагреваем его до того момента, пока он не начнет гореть. При горении рубидий будет выделять яркий фиолетовый или красный огонь.
2. Обратите внимание на красоту и необычность пламени, а также на то, как быстро рубидий горит и исчезает.
2. Эксперимент с водой и рубидием
Для этого эксперимента потребуется кусочек рубидия и небольшой стакан с водой.
1. Бросьте кусочек рубидия в стакан с водой и наблюдайте, что будет происходить. Обратите внимание на изменения внешнего вида рубидия и цвет воды.
2. Рубидий быстро реагирует с водой, образуя гидроксид рубидия и выделяя взрывоопасный газ – водород. Этот процесс сопровождается шипением и пузырьками в воде.
3. Эксперимент с рубидием и плотностью
Потребуется стакан с водой, кусочек рубидия и кусок льда.
1. Возьмите кусок рубидия и бросьте его в стакан с водой. Обратите внимание на то, что рубидий не растворяется в воде, а остается на поверхности.
2. Затем положите кусок льда в стакан с водой. Он станет тонуть в воде, так как его плотность выше, чем плотность воды. Рубидий, напротив, будет находиться на поверхности, так как его плотность ниже, чем плотность воды.
Это всего лишь несколько примеров интересных экспериментов с рубидием, которые помогут учащимся 9 класса узнать больше о свойствах этого удивительного металла и развить свой интерес к науке.
Удивительные химические свойства цезия

Цезий - щелочной металл, обладающий некоторыми удивительными химическими свойствами. Вот несколько интересных фактов о нем:
- Самый реакционный металл: Цезий является самым реакционным металлом из всех щелочных металлов. Он реагирует со многими элементами и соединениями, включая воду, кислород и азот.
- Пирофорный металл: Цезий также является пирофорным металлом, что означает, что он может воспламеняться при контакте с воздухом или водой. Это делает его очень опасным для обращения без необходимых предосторожностей.
- Высокая плотность: Цезий имеет очень высокую плотность - около 1,87 г/см³. Благодаря этой высокой плотности и его другим свойствам, цезий находит применение в различных технических и научных областях.
Цезий также обладает рядом других интересных свойств, таких как высокая теплопроводность и низкая электроотрицательность. Эти химические свойства делают его полезным для различных приложений, включая использование в термоэлектрических устройствах и атомных электростанциях.
Загадочные превращения французских металлов

Франция славится не только своими изысканными деликатесами и культурным наследием, но и интересными научными открытиями. Одной из примечательных областей французской науки являются исследования щелочных металлов.
Когда щелочные металлы вступают в реакцию с водой, происходят загадочные превращения. Например, литий начинает гореть ярким фиолетовым пламенем, натрий реагирует с водой с выделением водорода, а калий даже способен вызвать взрыв. Эти удивительные свойства металлов беспокоили ученых на протяжении многих лет, и только благодаря французским исследователям удалось разгадать некоторые из их загадок.
Особый вклад в изучение щелочных металлов внес французский химик Антуан Джером Чезар Парменье. В XIX веке он сумел выделить из калия новый элемент, который назвал цезием в честь планеты Церера. Существование этого элемента было предсказано другим французским химиком Густавом Робертом Кирем. С тех пор цезий стал объектом дальнейших исследований и использования в различных областях науки и техники.
Исследования французских ученых не только расширили наши знания о свойствах щелочных металлов, но и нашли практическое применение. Так, изотоп калия, полученный во время одного из экспериментов, нашел свое применение в аэрокосмической промышленности. Также благодаря исследованиям науки в области щелочных металлов ученые смогли разработать различные методы очистки и утилизации этих веществ, что имеет большое значение для экологии и сохранения окружающей среды.
Интересные факты о щелочных металлах

1. Щелочные металлы включают в себя литий, натрий, калий, рубидий, цезий и франций. Они относятся к первой группе периодической системы элементов и химически активны, что делает их интересными для изучения.
2. Щелочные металлы являются самыми реактивными металлами. Они имеют высокую электроотрицательность и легко реагируют с другими веществами, особенно с водой и кислородом.
3. Литий – самый легкий металл и самый низкоплавкий из щелочных металлов. Он обладает высокой электропроводностью и широко используется в производстве литий-ионных аккумуляторов.
4. Натрий – один из самых распространенных элементов в земной коре. Его соединения широко применяются в пищевой промышленности, медицине и нефтяной промышленности.
5. Калий – важный макроэлемент для живых организмов. Он играет важную роль в поддержании водного баланса и функционировании нервной системы.
6. Рубидий и цезий – самые редкие щелочные металлы. Они встречаются в небольших количествах в земной коре и используются в научных и медицинских исследованиях.
7. Франций – самый редкий и нестабильный щелочный металл. Его радиоактивность делает его очень опасным для окружающей среды и здоровья людей.
8. Щелочные металлы обладают характерными свойствами, такими как низкая плотность, низкая температура плавления и высокая теплопроводность. Эти свойства делают их полезными в различных областях науки и промышленности.
9. Щелочные металлы могут взаимодействовать с водой с выделением водорода и образованием щелочей. Это реакция характерна для всех щелочных металлов и является одним из самых известных и удивительных свойств этих элементов.
В целом, щелочные металлы представляют собой уникальную группу элементов, обладающих множеством интересных свойств и широким спектром применений. Изучение этих металлов не только расширяет наши знания о химических элементах, но и позволяет погрузиться в увлекательный мир химии.
Вопрос-ответ

Какие опыты можно провести с щелочными металлами для учеников 9 класса?
С учениками 9 класса можно провести различные интересные опыты с щелочными металлами. Например, опыт с добавлением кусочка натрия в воду, который приведет к сильному выбросу воды вверх и возгоранию натрия. Также можно провести опыт с калием, который поджигается и излучает фиолетовый пламя.
Где можно приобрести щелочные металлы для проведения опытов?
Щелочные металлы, такие как натрий и калий, можно приобрести в химических магазинах или интернет-магазинах, специализирующихся на химических реагентах. Необходимо учитывать, что использование этих веществ требует особой осторожности и наблюдения со стороны взрослых.
Какие безопасные меры следует принять при проведении опытов с щелочными металлами?
При проведении опытов с щелочными металлами следует соблюдать определенные меры безопасности. Необходимо носить защитные очки и перчатки, чтобы защитить глаза и кожу от возможных ожогов. Также опыты следует проводить в хорошо проветриваемом помещении или под вытяжкой, чтобы избежать поступления ядовитых паров в организм.
Какие результаты можно получить при проведении опыта с добавлением натрия в воду?
При добавлении кусочка натрия в воду происходит сильное выбросов существующей воды вверх, а натрий догоревает с ярким пламенем и образует горячий газообразный оксид натрия. Полученный газ обладает сильными обжигающими свойствами и может вызывать раздражение глаз и дыхательных путей.
Какие опыты с щелочными металлами можно провести дома?
Существуют опыты с щелочными металлами, которые можно провести дома, но при этом необходимо соблюдать особую осторожность. Например, можно провести опыт с добавлением небольшого кусочка натрия в воду в простой пластиковой бутылке, чтобы увидеть выброс воды и яркое пламя. Однако перед проведением любых опытов следует проконсультироваться с родителями и учителем химии.
