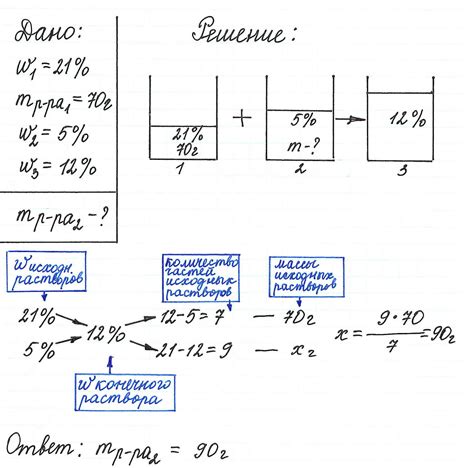
Метод титрования является одним из основных методов определения концентрации растворов химических веществ. Данный метод основан на реакции химического взаимодействия двух реагентов, при котором исследуемое вещество оказывается в избытке и может быть полностью использовано для превращения реагента-титранта. В этой статье рассмотрим определение концентрации раствора перманганата калия методом титрования по железу.
Перманганат калия (KMnO4) - кислотный окислитель, который в растворах ионизируется, образуя сильно окрашенный ион MnO4-. Переход MnO4- в бесцветное соединение Mn2+ может происходить только в присутствии сильных восстановителей, таких как ионы железа в двухвалентной степени окисления (Fe2+).
Процесс титрования заключается в добавлении раствора перманганата к кислому раствору образца, содержащего неизвестную концентрацию ионы железа. Сначала все ионы железа приводятся в двухвалентное состояние, а затем непрореагировавшее количество перманганата калия устанавливает конечный остаточный фиолетовый цвет раствора.
Титрование по железу позволяет определить концентрацию раствора перманганата калия, используя физическое наблюдение изменения окраски реакционной смеси. Этот метод является одним из наиболее точных и простых способов определения концентрации пероксидов, соединений валентного состояния железа и других химически активных веществ.
Что такое концентрация раствора перманганата калия?
Концентрация раствора перманганата калия – это величина, которая определяет количество перманганата калия, содержащегося в единице объема раствора. Она выражается в моль на литр (моль/л) или грамм на литр (г/л).
Перманганат калия (KMnO4) – это сильный окислитель, который широко используется в аналитической химии. Он имеет фиолетовый цвет и, благодаря своим окислительным свойствам, может быть использован для определения концентрации различных веществ.
Метод титрования по железу является одним из способов определения концентрации раствора перманганата калия. Этот метод основан на том, что перманганат калия окисляет ионы железа (II) до ионов железа (III) в кислой среде.
При проведении титрования по железу с помощью перманганата калия, определяют точный объем раствора перманганата, который необходим для полного окисления ионов железа (II) до железа (III). Из этого объема и известной концентрации перманганата калия можно определить концентрацию раствора перманганата с помощью простого математического расчета.
Определение концентрации раствора

Определение концентрации раствора перманганата калия методом титрования по железу является одним из наиболее распространенных и точных методов определения концентрации химического раствора. Этот метод основан на принципе взаимодействия перманганата калия с ионами железа, которые окисляются до ионов железа(III), а перманганат калия одновременно восстанавливается.
Для проведения данного эксперимента необходимо иметь точные количественные пробы перманганата калия и стандартного раствора железа. Подготавливаются их растворы определенной концентрации. Перманганат калия обладает яркой фиолетовой окраской, а раствор железа обычно имеет желто-красный цвет.
Титрование проводится путем постепенного вливания раствора перманганата калия в количество стандартного раствора железа до появления устойчивого, красно-бурым цветом раствора. По объему израсходованного раствора перманганата калия можно определить его концентрацию.
Для более точного определения концентрации раствора часто используются точные индикаторы, которые изменяют окраску при достижении эквивалентной точки титрования. Также можно использовать менее концентрированный перманганат калия и применять индикаторы, которые изменяют окраску в более широком диапазоне концентраций.
Принцип метода титрования по железу
Метод титрования по железу является одним из наиболее распространенных методов определения концентрации растворов перманганата калия. Основной принцип этого метода заключается в реакции окисления восстановления, при которой перманганат и железо взаимодействуют в растворе.
В процессе титрования по железу, раствор перманганата калия добавляется к раствору, содержащему железо. На начальной стадии титрования, перманганаты и железо взаимодействуют и происходит окисление железа из двухвалентного состояния до трехвалентного состояния. При этом перманганат переходит в менее окрашенное состояние - оксид марганца.
Процесс титрования продолжается до полного окисления железа и полного разложения перманганата калия. Конечная точка титрования определяется с помощью индикатора - заранее добавленного в раствор, на основе которого можно определить концентрацию перманганата калия.
Определение концентрации раствора перманганата калия методом титрования по железу является точным и надежным способом, при условии соблюдения всех необходимых условий, таких как подготовка растворов, правильный подбор индикатора и тщательное проведение титрования.
Шаги проведения титрования

1. Подготовка реактивов
Перед началом титрования необходимо приготовить раствор перманганата калия и раствор соляной кислоты. Раствор перманганата калия следует приготовить с известной концентрацией, которая будет определяться в ходе титрования. Раствор соляной кислоты используется для поддержания кислой среды в реакционной смеси.
2. Подготовка пробы
Для проведения титрования необходимо точно измерить определенный объем пробы, содержащей перманганатно-калиевые ионы. Пробу можно взять из раствора, который нужно определить по концентрации.
3. Ввод реактивов
В пробу необходимо добавить измеренное количество раствора соляной кислоты, чтобы создать кислую среду для протекания реакции окисления. Затем в пробу добавляют раствор перманганата калия до появления стойкой фиолетовой окраски.
4. Титрование
Титрование проводят с использованием раствора сульфата железа(II), который служит титрантом. Сульфат железа(II) реагирует с перманганатными ионами, превращая их в ионы марганца(II). По мере реакции фиолетовая окраска пробы будет постепенно исчезать. Титрование следует проводить, добавляя титрант по каплям и встряхивая пробу для хорошего перемешивания.
5. Определение концентрации
Концентрация раствора перманганата калия определяется при полном изменении окраски пробы. Точку эквивалентности можно определить по изменению окраски с розово-фиолетовой на безцветную. По затраченному количеству титранта можно рассчитать концентрацию раствора перманганата калия с помощью уравнения стехиометрии реакции.
Расчет концентрации раствора
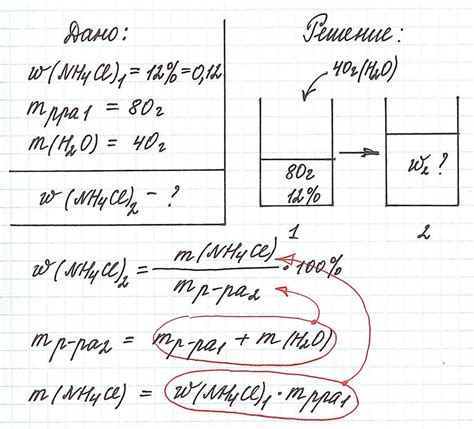
Для определения концентрации раствора перманганата калия методом титрования по железу необходимо провести ряд измерений и математических расчетов. Этот метод основан на реакции окисления перманганат-ионами железа(II) в кислой среде.
Для начала нужно взять определенный объем раствора перманганата калия и добавить его к раствору, содержащему железо. После этого происходит реакция окисления железа(II) до железа(III), а перманганат-ионы переходят в состояние марганцевых ионов.
Далее следует титрование получившегося раствора раствором сульфатного раствора аммония. По количеству добавленного раствора аммония можно определить количество окисленного железа(II) и, соответственно, концентрацию раствора перманганата калия.
Расчет концентрации раствора производится по формуле:
CМК = (V2 * C1 * 5) / V1
где CМК - концентрация раствора перманганата калия, V2 - объем раствора аммония, C1 - концентрация раствора аммония, V1 - объем раствора перманганата калия.
В результате проведенных расчетов можно получить точное значение концентрации раствора перманганата калия методом титрования по железу.
Вопрос-ответ

Зачем нужно определять концентрацию раствора перманганата калия?
Определение концентрации раствора перманганата калия важно для регулирования дозировки этого вещества при его использовании в лабораториях, производственных процессах и в бытовых целях.
Каким методом определяется концентрация раствора перманганата калия?
Концентрация раствора перманганата калия определяется методом титрования по железу. В процессе титрования раствор перманганата калия добавляется к раствору, содержащему железо, пока не достигается точка перехода раствора из красного цвета в безцветный.
Какие реагенты используются для титрования раствора перманганата калия по железу?
Для титрования раствора перманганата калия по железу используются реагенты: раствор перманганата калия, раствор сульфата аммония, раствор серной кислоты и раствор ферроцианида калия.
Что происходит в процессе титрования раствора перманганата калия по железу?
В процессе титрования раствора перманганата калия по железу происходит окислительно-восстановительная реакция. Перманганат калия окисляет двухвалентное железо до трехвалентного, при этом сам редуцируется до ионов марганца. При достижении точки эквивалентного перехода раствор перманганата калия изменяет цвет с красного на безцветный.
Как определить точку эквивалентного перехода раствора перманганата калия в процессе титрования?
Точка эквивалентного перехода раствора перманганата калия в процессе титрования определяется визуально, когда красный цвет раствора перманганата калия становится безцветным.
