В химии металлы часто выделяются на электроде при электролизе. Этот процесс является важной методикой определения массы выделившегося металла. Она основана на принципе сохранения массы в химических реакциях.
Для определения массы металла, выделившегося на катоде, необходимо знать его стехиометрический коэффициент в химическом уравнении реакции. Степень окисления металла на катоде равна нулю, что позволяет легко определить его количество по плотности тока и времени электролиза.
Для проведения эксперимента достаточно установить электрод из металла, выделение которого нужно измерить, в раствор соответствующих солей. Затем, приложив электрическое напряжение между электродами, металл начинает осаждаться на катоде. Путем измерения времени и плотности тока можно определить массу выделившегося металла.
Принцип электролиза и образование металла на катоде
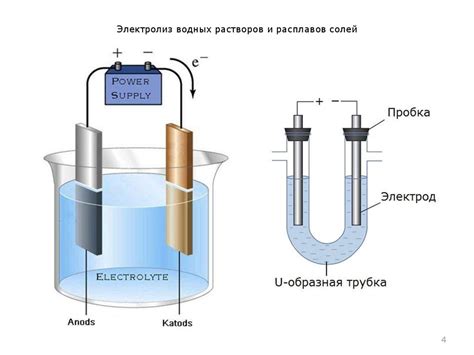
Электролиз – это процесс разложения вещества путем применения электрического тока. В процессе электролиза важную роль играют два электрода: катод и анод. Катод – это электрод, на котором происходит процесс восстановления вещества.
Принцип электролиза заключается в подаче электрического тока на электролит – вещество, способное проводить электрический ток. При этом, положительно заряженные ионы вещества начинают двигаться к отрицательно заряженному катоду, где они получают электроны, что приводит к их восстановлению и образованию металла на катоде.
Масса металла, выделившегося на катоде при электролизе, зависит от ряда факторов, таких как время процесса, электрический ток, концентрация вещества и площадь катода. Для определения массы металла можно использовать основные законы электролиза, такие как закон Фарадея, который определяет количество вещества, выделившегося на электродах, и закон сохранения массы, который гласит, что масса вещества, выделившегося на катоде, равна массе вещества, прошедшего через электролит и окислившегося на аноде.
Для достоверного определения массы металла на катоде необходимо провести эксперименты, учитывая все факторы, влияющие на электролиз, и использовать математические формулы, позволяющие рассчитать количество и массу выделившегося металла на катоде.
Необходимые данные для расчета массы металла
Для определения массы металла, выделившегося на катоде при электролизе, необходимо учесть несколько параметров и величин. Перед проведением расчетов следует получить следующие данные:
- Заряд электролизера (Q): измеряется в количестве перенесенных зарядов (Кл) и можно получить путем умножения силы тока на время электролиза.
- Молярная масса металла (M): указывается в г/моль и зависит от вида металла, который выделяется на катоде.
- Количество молей выделившегося металла (n): можно получить путем деления заряда электролизера на заряд электрона (1,6 * 10^-19 Кл).
После получения этих данных можно расчитать массу металла выделившегося на катоде по формуле:
m = n * M
где:
- m - масса металла выделившегося на катоде (г);
- n - количество молей выделившегося металла;
- M - молярная масса металла.
Итак, для определения массы металла выделившегося на катоде при электролизе следует знать заряд электролизера, молярную массу металла и количество молей выделившегося металла. Используя эти данные и применяя соответствующую формулу, можно получить искомую величину.
Методы определения массы металла

Определение массы металла, выделившегося на катоде при электролизе, может быть осуществлено с помощью различных методов. Один из таких методов - метод гравиметрического анализа, который основан на измерении массы вещества. Сначала из раствора осаждается металл на катоде, затем осадок тщательно вымывается и высушивается. После этого он взвешивается на точных аналитических весах. Разница массы до и после электролиза позволяет определить массу выделившегося металла.
Еще одним методом определения массы металла является метод кулонометрического анализа. В этом методе измеряется количество электричества, прошедшего через электролит, а затем с помощью стехиометрического соотношения между количеством электричества и массой металла определяется масса выделившегося металла.
Кроме того, можно использовать метод спектрального анализа для определения массы металла. При этом производится измерение интенсивности излучения с помощью спектрального прибора, а затем сравнивается с известной зависимостью интенсивности излучения от концентрации металла. По этой зависимости можно определить массу металла.
Также существует метод вольтамперометрического анализа, основанный на измерении зависимости потенциала и токового проходящего через электроды электролита от времени или других параметров. По этим данным можно рассчитать массу выделившегося металла.
В таблице ниже представлено сравнение различных методов определения массы металла:
| Метод | Принцип | Преимущества | Недостатки |
|---|---|---|---|
| Гравиметрический анализ | Измерение массы осадка металла | Высокая точность, простота | Длительность процесса |
| Кулонометрический анализ | Измерение количества электричества | Быстрота, высокая точность | Зависимость от стехиометрии реакции |
| Спектральный анализ | Измерение интенсивности излучения | Быстрота, возможность определения следовых концентраций | Необходимость специализированных приборов |
| Вольтамперометрический анализ | Измерение потенциала и тока электролиза | Быстрота, возможность измерения в реальном времени | Влияние других процессов на результаты измерений |
Обработка результатов и получение окончательной массы
Шаг 1: Соберите все данные и результаты эксперимента, которые были получены в процессе электролиза. Включите в них начальную и конечную массу катода, длительность проведения электролиза и другие существующие параметры.
Шаг 2: Используя полученные данные, рассчитайте изменение массы катода. Для этого нужно вычесть начальную массу катода из конечной массы катода.
Шаг 3: Для получения окончательной массы металла, выделившегося на катоде, учтите возможные погрешности и исправления. Погрешности могут возникать из-за несовершенства оборудования, методики проведения эксперимента или других факторов. Исправления могут понадобиться, например, если была использована неправильная формула для расчета массы.
Шаг 4: Дополнительно, вы можете сравнить результаты с теоретическими значениями. Сравнение с теорией поможет вам оценить точность и достоверность полученных данных. Если результаты сильно отличаются от теоретических значений, это может указывать на наличие ошибок в проведении эксперимента или неправильные предположения о совершенстве системы.
Шаг 5: Оформите результаты в виде таблицы или графика для более удобного представления данных. Таблица может содержать значения начальной и конечной массы катода, изменение массы, погрешности и другие важные сведения.
Шаг 6: Сделайте заключение на основе полученных результатов и их анализа. Обратите внимание на сходство или отличие результатов от ожидаемых значений и объясните возможные причины этих отличий. Подведите общие итоги эксперимента и оцените его успех или неудачу.
Вопрос-ответ

Можно ли определить массу металла, выделившегося на катоде, при электролизе?
Да, можно определить массу металла, выделившегося на катоде при электролизе с помощью закона Фарадея. Закон Фарадея гласит, что количество вещества, выделившегося или осажденного на электроде, прямо пропорционально заряду, прошедшему через электролит. Следовательно, масса металла можно определить, зная заряд электролизера и эквивалентный вес металла. Эквивалентный вес металла определяется как молярная масса металла, деленная на изменение заряда в сторону увеличения степени окисления.
Какие данные необходимы для определения массы металла, выделившегося на катоде при электролизе?
Для определения массы металла, выделившегося на катоде при электролизе, необходимо знать заряд электролизера (количество проведенного через него электричества, измеряемого в кулонах) и эквивалентный вес металла. Эквивалентный вес металла зависит от его молярной массы и изменения заряда в сторону увеличения степени окисления или уменьшения степени восстановления. Зная эти данные, можно применить закон Фарадея и определить массу металла.
