В химии и физике существует понятие числа электронов на внешнем уровне атома. Это число определяет химические свойства атома и его способность образовывать химические соединения. Отличие металлов от неметаллов заключается, в том числе, и в числе электронов на их внешнем уровне.
Металлы обладают относительно небольшим числом электронов на внешнем уровне. Обычно это один или несколько электронов. Из-за такого небольшого количества электронов металлы имеют склонность отдавать эти электроны и образовывать позитивно заряженные ионы. Именно благодаря этому принципу металлы проявляют свою металлическую проводимость и хорошую термическую и электрическую проводимость.
В отличие от металлов, неметаллы имеют относительно большое число электронов на внешнем уровне, обычно от трех до восьми электронов. Неметаллы имеют склонность принимать электроны от других атомов и образовывать отрицательно заряженные ионы. Именно благодаря этой особенности неметаллы проявляют свою способность к образованию сильных химических связей и обладают высокой электроотрицательностью.
Число электронов на внешнем уровне

Электроны на внешнем уровне – это электроны, находящиеся на самом активном энергетическом уровне атома. Они обладают наибольшей потенциальной энергией и определяют химические свойства атома.
У металлов и неметаллов различное число электронов на внешнем уровне. У металлов обычно от одного до трех электронов на внешнем уровне, в то время как у неметаллов электронов на внешнем уровне может быть от одного до восьми.
Металлы, имеющие малое число электронов на внешнем уровне, обладают выраженными металлическими свойствами, такими как хорошая электропроводность и теплопроводность. Например, у меди на внешнем уровне находится всего один электрон.
Неметаллы, в отличие от металлов, имеют более чем один электрон на внешнем уровне. У некоторых неметаллов, таких как кислород и сера, на внешнем уровне находятся шесть электронов. Эти электроны обладают большой силой притяжения к ядру и часто стремятся образовать ковалентные связи с другими атомами, чтобы достичь стабильности.
Число электронов на внешнем уровне играет ключевую роль в химических реакциях и определении химических свойств веществ. Оно влияет на способность атомов образовывать химические связи и участвовать в реакциях с другими веществами.
Металлы

Металлы представляют собой группу элементов, которые обладают рядом характеристических свойств. Особенностью металлов является наличие свободных электронов на их внешнем энергетическом уровне. У металлов внешний энергетический уровень обычно содержит одну или несколько энергетических подуровней, на которых находятся свободные электроны.
Свободные электроны являются основной причиной многих характерных свойств металлов, таких как высокая электропроводность, теплопроводность и металлический блеск. Свободные электроны обладают возможностью передвигаться внутри металлической решетки под воздействием внешних электрических полей, что обуславливает электропроводность металлов.
На внешнем энергетическом уровне у металлов находится от одного до трех электронов, что делает их очень реакционноспособными. Металлы обычно образуют катионы, т.е. ионы с положительным зарядом, потому что теряют свои внешние электроны при образовании химических соединений.
Металлы обладают высокой пластичностью и удельными весами. Они способны поддаваться деформации без разрушения, что делает их идеальными для использования в различных отраслях промышленности. Большинство металлов имеют серебристо-серый цвет, однако некоторые из них, такие как медь и золото, обладают характерными цветами.
Неметаллы

Неметаллы - это химические элементы, которые обладают особыми свойствами: не проводят электрический ток, обычно являются хорошими изоляторами, имеют низкую температуру плавления и высокую температуру кипения. Также неметаллы обычно образуют отрицательные ионы и обладают более высокой электроотрицательностью по сравнению с металлами.
Наиболее известными неметаллами являются кислород, азот, сера, фосфор и хлор. Кислород, например, имеет 6 электронов на внешнем уровне и тяготеет к получению двух дополнительных электронов для приобретения стабильной октетной конфигурации.
Неметаллы образуют широкий спектр соединений с металлами и другими неметаллами. Отрицательно заряженные ионы неметаллов, такие как кислород, могут образовывать ионные связи со с положительно заряженными ионами металлов. Кроме того, неметаллы могут образовывать и ковалентные связи с другими неметаллами, обменивая электроны и образуя молекулярные соединения.
Некоторые неметаллы имеют важное применение в повседневной жизни. Например, кислород используется в дыхательной системе, азот используется в сельском хозяйстве для удобрения почвы, а хлор используется для очистки воды и в производстве химических веществ.
Различия между металлами и неметаллами

Металлы и неметаллы — это два основных класса химических элементов в периодической системе. Они отличаются своими физическими и химическими свойствами, включая число электронов на внешнем энергетическом уровне.
У металлов обычно от 1 до 3 электронов на внешнем уровне. Они обладают металлическими свойствами, такими как высокая теплопроводность, электропроводность и гибкость. Металлы легко сгибаются, их легко обрабатывать и формировать, они блестят и могут быть расплавлены при высоких температурах.
С другой стороны, неметаллы обычно имеют от 4 до 8 электронов на внешнем уровне. Они имеют неметаллические свойства, такие как низкая теплопроводность и электропроводность. Неметаллы обычно хрупкие, не могут быть сшиты, они не блестят и плохо плавятся.
Кроме того, металлы и неметаллы имеют разные реакции при вступлении в химические соединения. Металлы обычно образуют положительные ионы, тогда как неметаллы могут образовывать отрицательные ионы или разделять электроны с другими элементами.
Важно отметить, что существуют также полуметаллы, которые имеют свойства как металлов, так и неметаллов. Они расположены вблизи линии, разделяющей металлы и неметаллы в периодической системе.
Металлическая связь

Металлическая связь является одной из основных видов химической связи, характерной для металлов. Она образуется между атомами металла благодаря общему использованию внешних электронов.
Металлы имеют относительно небольшое количество электронов на своем внешнем энергетическом уровне, что позволяет им легко отдавать эти электроны другим атомам. В результате создается плотная сеть, в которой электроны свободно перемещаются между атомами металла.
Появление металлической связи связано с образованием так называемого металлического кристаллического решетки, которая создается между атомами металла. В этой решетке электроны образуют "облако" вокруг положительно заряженных ядер атомов металла.
Металлическая связь обладает рядом уникальных свойств, таких как хорошая электропроводность, хорошая теплопроводность и пластичность металлов. Эти свойства обусловлены способностью электронов свободно перемещаться внутри металлической решетки.
Ковалентная связь
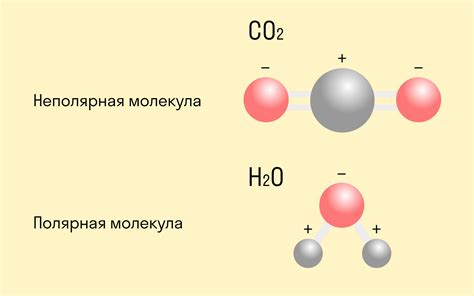
Ковалентная связь – это тип химической связи, который образуется между атомами, когда они делят один или несколько электронов. В отличие от ионной связи, где электроны передаются с одного атома на другой, при ковалентной связи электроны общие.
К этому типу связи обычно стремятся неметаллы, так как они имеют недостаток электронов на внешнем уровне. В процессе образования ковалентной связи, два атома вкладывают свои электроны в общий электронный облако. Это общее электронное облако образует пару связанных электронов, которая привлекается обоими атомами.
Ковалентная связь может образовываться между атомами одного элемента (полностью общая пара электронов) или между различными элементами (неполностью общая пара электронов). При этом каждый атом вносит свои неспаренные электроны для образования связи, чтобы достичь стабильной электронной конфигурации.
Ковалентные связи характерны для неметаллов и обусловливают такие свойства, как высокая температура плавления и кипения, прочность и твердость, а также непроводимость электрического тока в некоторых случаях. Эти связи являются сильными и обычно требуют большого количества энергии для их разрыва.
Вопрос-ответ

Что такое внешний уровень электрона?
Внешний уровень электрона - это энергетический уровень, на котором находятся электроны в атоме ионизированных веществ, а также на внешнем уровне находятся только валентные электроны, которые принимают участие в химических реакциях.
В чем отличие металлов от неметаллов по числу электронов на внешнем уровне?
Металлы обычно имеют малое количество электронов на внешнем уровне. Например, щелочные металлы имеют один электрон на внешнем уровне, щелочноземельные металлы имеют два электрона на внешнем уровне. При этом, неметаллы обычно имеют большее количество электронов на внешнем уровне, например, кислород имеет шесть электронов на внешнем уровне, хлор - семь электронов.
Почему металлы имеют малое количество электронов на внешнем уровне?
Металлы имеют малое количество электронов на внешнем уровне, потому что они стремятся обретать стабильность. Малое количество электронов на внешнем уровне позволяет металлам образовывать металлические связи, в результате чего они обретают стабильное, кристаллическое строение и высокую электропроводность.
