Взаимодействие металлов с растворами кислот является одной из основных тем в области химии. Этот процесс может приводить к различным химическим реакциям и иметь различные последствия, включая образование солей и выделение газов.
Основным фактором, определяющим характер взаимодействия металлов с кислотами, является их электрохимический потенциал. Металлы с более высоким потенциалом, такие как цинк или алюминий, обычно реагируют более активно с кислотами, чем металлы с более низким потенциалом, такие как медь или свинец.
Реакция металлов с кислотами может приводить к выделению газов, таких как водород или оксиды азота. Они могут создавать опасные условия, особенно при работе с крупными масштабами или в неудобных условиях. Поэтому необходимо соблюдать осторожность и принимать соответствующие меры предосторожности при проведении экспериментов или работе с металлами и кислотами.
Металлы в растворах кислот: основная информация

Металлы, взаимодействующие с растворами кислот, обладают рядом особенностей и характерных последствий. Кислоты являются химическими соединениями, которые обладают высокой активностью и способностью отдавать протоны. Взаимодействие металлов с растворами кислот приводит к реакциям, которые могут иметь как положительные, так и негативные последствия.
При взаимодействии металлов с растворами кислот часто происходит образование солей. Соли - это химические соединения, состоящие из катиона металла и аниона кислотного остатка. Образование солей может иметь различные физические и химические свойства, которые зависят от химической природы металла и кислоты.
Взаимодействие металлов с растворами кислот также может приводить к выделению газов. Например, при взаимодействии цинка с соляной кислотой образуется газ водород. Эти реакции часто используются в лабораторной практике для получения газов или очистки металлических поверхностей.
Однако, взаимодействие металлов с растворами кислот может иметь и негативные последствия. Некоторые металлы могут быть разрушены или коррозировать при контакте с кислотами. Это связано с тем, что кислоты могут проникать в металлическую структуру и вызывать ее разрушение. Поэтому необходимо учитывать химическую совместимость металлов с кислотами при выборе материалов для различных технических или промышленных целей.
Определение и классификация металлов
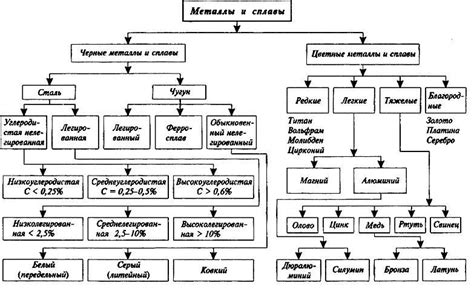
Металлы - это класс химических элементов, характеризующихся высокой теплопроводностью, электропроводностью, пластичностью и блеском. Они представляют собой основные строительные блоки материального мира и широко используются в промышленности, строительстве и других отраслях нашей жизни.
Металлы можно классифицировать по различным признакам, например, по происхождению, химическим свойствам и структуре.
По происхождению металлы делятся на две группы: природные и искусственные. Природные металлы образуются в процессе геологических процессов и встречаются в земной коре, в то время как искусственные металлы получены путем специальной обработки и промышленного производства.
По химическим свойствам металлы могут быть разделены на две группы: активные и инертные. Активные металлы обладают высокой реакционной способностью и легко вступают в химические реакции, например, с кислотами. Инертные металлы, напротив, имеют низкую химическую активность и обычно не взаимодействуют с большинством реагентов.
По структуре металлы классифицируют на кристаллические и аморфные. Кристаллические металлы обладают упорядоченной решеткой атомов, что придает им определенные механические и термические свойства. Аморфные металлы, напротив, не имеют упорядоченной структуры и обладают уникальными свойствами, такими как высокая прочность и возможность легкого формования в разные изделия.
Все эти классификации позволяют нам лучше понять разнообразие металлов и их особенности во взаимодействии с различными средами, включая растворы кислот. Дальнейшее изучение этой темы поможет нам проникнуть в суть химических процессов, которые происходят при взаимодействии металлов с кислотами и понять последствия, которые это взаимодействие может иметь для окружающей среды и нашего здоровья.
Взаимодействие металлов с растворами кислот
Взаимодействие металлов с растворами кислот является одним из важных процессов в химии. Оно имеет свои особенности и может приводить к различным последствиям.
Когда металл погружается в раствор кислоты, происходит реакция между металлом и ионами кислоты. В результате этой реакции образуются соответствующие соли и выделяется водород. Это можно наблюдать, например, при взаимодействии цинка с раствором соляной кислоты:
Zn + 2HCl → ZnCl2 + H2
При данной реакции образуется хлорид цинка и выделяется молекула водорода. Такие реакции происходят и с другими металлами, например, с железом, алюминием, медью и т.д.
Некоторые металлы, такие как алюминий, обладают защитными свойствами и образуют пассивную пленку на поверхности при взаимодействии с кислотой. Эта пленка защищает металл от дальнейшего разрушения и окисления. Однако другие металлы, например, железо, подвержены коррозии и могут реагировать с кислотой более активно.
Взаимодействие металлов с растворами кислот имеет различные практические применения. Например, в процессе гальванизации, металлы покрываются тонким слоем другого металла путем взаимодействия с кислотным раствором. Этот процесс используется для защиты металлических поверхностей от коррозии и придания им декоративных свойств.
Поэтому изучение взаимодействия металлов с растворами кислот является важным для понимания многих химических и физических процессов и имеет широкие практические применения.
Особенности взаимодействия металлов с растворами кислот

Взаимодействие металлов с растворами кислот имеет свои особенности, которые определяют химические и физические процессы, происходящие в этой реакции.
Прежде всего, следует отметить, что металлы могут реагировать с кислотами только при наличии свободных электронов на их поверхности. Поэтому металлическая поверхность должна быть чистой и не покрытой оксидными или другими слоями.
Кроме того, реактивность металла зависит от его положения в ряду активности металлов. Поэтому некоторые металлы, такие как натрий или калий, реагируют с кислотами очень активно и быстро, образуя соляные растворы и выделяя водород. В то время как другие металлы, например, медь или серебро, реагируют гораздо медленнее или вообще не реагируют.
В процессе взаимодействия металла с кислотой происходит образование солей и выделение водорода. Соли растворяются в воде, образуя ионы, которые могут растворяться вещества и проводить электрический ток. Выделение водорода происходит за счет вытеснения его ионами металла из кислотных растворов.
Важно отметить, что реакция металла с кислотой может протекать с разной степенью интенсивности и возможностями контроля. Интенсивность реакции зависит от концентрации кислоты и металла, а также от температуры и давления. Поэтому необходимо учитывать эти факторы при проведении экспериментов или использовании металлов в различных промышленных процессах.
Последствия взаимодействия металлов с растворами кислот:

1. Коррозия - это одно из основных последствий взаимодействия металлов с растворами кислот. При контакте металла с кислотой происходит окисление металла, образуется кислород и происходит разрушение поверхности металла. В результате образуются белые, серые или желтые осадки, а также пузыри газа. Коррозия может привести к деформации и разрушению металлических изделий, что имеет негативные последствия для различных отраслей промышленности.
2. Изменение физико-химических свойств металла. Взаимодействие металлов с растворами кислот может привести к изменению их цвета, текстуры и силы. Например, при контакте железа с раствором соляной кислоты образуется хлорид железа, который имеет зеленоватую окраску и более хрупкую структуру по сравнению с исходным металлом. Такие изменения могут сказаться на производственных или эксплуатационных свойствах металла.
3. Отравление и загрязнение окружающей среды. Взаимодействие металлов с кислотами может привести к выделению вредных веществ, которые могут быть опасны для человека и окружающей среды. Например, при контакте свинца с раствором соляной кислоты выделяется клорид свинца, который является токсичным веществом. Такое загрязнение может иметь негативные последствия для здоровья и экосистемы в целом.
4. Реакции взаимодействия металлов с растворами кислот могут сопровождаться выделением тепла или образованием газов. Это может привести к повышению температуры среды, изменению давления и возникновению опасных условий. Например, при контакте алюминия с раствором соляной кислоты выделяются газы, что может привести к возгоранию или даже взрыву. Поэтому необходимо соблюдать предостережения и меры безопасности при работе с металлами и кислотами.
Вопрос-ответ

Какие металлы взаимодействуют с кислотами?
С разными кислотами взаимодействуют разные металлы. Например, самые активные металлы, такие как натрий, калий, магний, алюминий, реагируют с кислотами, даже с слабыми, такими как уксусная или соляная. Другие металлы, такие как железо и цинк, взаимодействуют с кислотами более слабо и требуют более сильных, например, соляной или серной кислот. Также есть металлы, которые не реагируют с кислотами вообще, например, золото или платина.
Что происходит при взаимодействии металлов с кислотами?
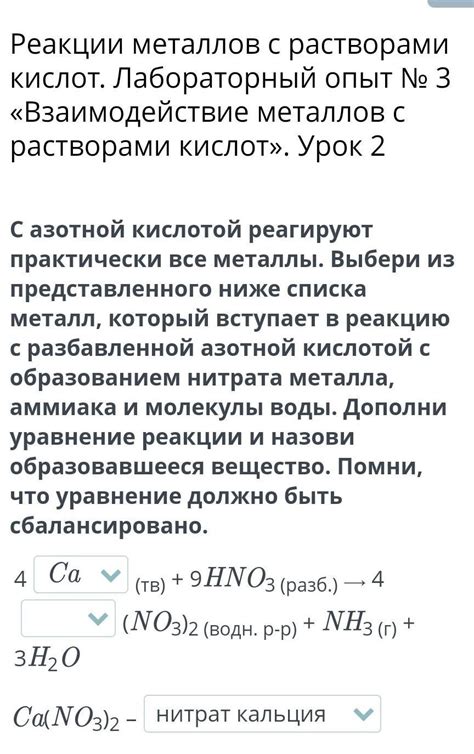
При взаимодействии металлов с кислотами обычно происходит образование солей и выделение водорода. К примеру, при реакции цинка с соляной кислотой образуется соль цинка (хлорид цинка) и выделяется водород. Уравнение реакции: Zn + 2HCl -> ZnCl2 + H2. Такие реакции позволяют использовать металлы для получения солей или для выделения водорода.
