Взаимодействие металлов с неметаллами и водой является важной темой, которая изучается в химии. В этом процессе металлы проявляют свою химическую активность и способность взаимодействовать с неметаллами и водой.
Одной из основных особенностей взаимодействия металлов с неметаллами и водой является образование химических соединений. В результате реакции металлов с неметаллами и водой образуются различные соединения, которые могут иметь как полезные, так и вредные свойства.
Процесс взаимодействия металлов с неметаллами и водой связан с выделением энергии. Реакции, происходящие между металлами и неметаллами, и металлами и водой, могут сопровождаться выделением тепла и света. Это происходит из-за изменения энергии связи между атомами веществ.
Кроме того, взаимодействие металлов с неметаллами и водой может приводить к образованию оксидов и гидроксидов. Эти соединения являются основой многих химических реакций, происходящих при взаимодействии металлов с неметаллами и водой. Они могут обладать различными свойствами, такими как кислотность и щелочность, и играть важную роль в различных химических процессах.
Взаимодействие металлов с неметаллами

Металлы и неметаллы могут вступать в различные виды химических реакций, в результате которых образуются разнообразные соединения. Взаимодействие металлов с неметаллами осуществляется через передачу или обмен электронами между атомами веществ.
Одним из наиболее распространенных типов реакций является образование солей – соединений, состоящих из металлического катиона и неметаллического аниона. Примером такого взаимодействия может служить реакция между хлоридом натрия (NaCl) и серной кислотой (H2SO4), которая приводит к образованию хлорида серебра (AgCl) и сульфата натрия (Na2SO4).
Взаимодействие металлов с неметаллами может также приводить к образованию окислителей и восстановителей. В реакции окисления металл образует положительный ион (катион), а неметалл – отрицательный ион (анион). Так, при взаимодействии железа (Fe) с кислородом (O2) образуется оксид железа (Fe2O3), где железо находится в виде катиона Fe3+, а кислород – в виде аниона O2-.
Известными примерами взаимодействия металлов с неметаллами являются также кислотно-основные реакции. В результате этих реакций образуются соли и вода. Например, при взаимодействии цинка (Zn) с серной кислотой (H2SO4) происходит образование сульфата цинка (ZnSO4) и выделение газа – сероводорода (H2).
Интересные свойства проявляют металлы в периодической системе, расположенные в правом верхнем углу – это так называемые неразложимые металлы. Их химическое взаимодействие с неметаллами и водой ограничивается, они реакционной способностью не обладают.
Таким образом, взаимодействие металлов с неметаллами и водой имеет разнообразные проявления в химических реакциях, и оно определяется свойствами элементов веществ, их электронной структурой и другими факторами.
Процесс и результат
Процесс взаимодействия металлов с неметаллами и водой является сложным и многогранным. Когда металл контактирует с неметаллом в присутствии воды, происходит химическая реакция, в результате которой образуются соединения и обмен электронами.
Результатом взаимодействия металлов с неметаллами и водой может быть образование ионообразных соединений или оксидов. Например, при взаимодействии натрия с водой образуется щелочная соль – гидроксид натрия и выделение водорода. Также возможна реакция оксидации металла водным паром с образованием соответствующего оксида и водорода.
Взаимодействие металлов с неметаллами и водой может быть сопровождено выделением тепла или холода. Например, при реакции алюминия с водой выделяется большое количество тепла, что приводит к растворению металла. Однако некоторые металлы, например, медь, не реагируют с водой или реагируют слабо, поэтому их используют для изготовления водопроводных труб и других изделий, не подверженных коррозии.
Взаимодействие металлов с неметаллами и водой имеет большое значение в промышленности и научных исследованиях. Изучение этих процессов позволяет разрабатывать новые материалы и исследовать их свойства, а также использовать их для получения энергии и производства различных химических соединений.
Реакция металлов с водой

Многие металлы проявляют активность при контакте с водой и происходит их реакция. В результате реакции с водой металлы образуют гидроксиды или водород.
При контакте с водой, некоторые металлы, такие как литий, натрий и калий, проявляют сильную активность и реагируют с водой горячими металлическими шарами, испуская газообразный водород. Данная реакция протекает достаточно быстро и сопровождается выделением тепла.
Однако, некоторые металлы, например, магний и алюминий, reageren с водой, но при этом реакция протекает гораздо медленнее. Металл покрывается слоем оксида, в результате чего реакция замедляется и прекращает происходить. Эти металлы реагируют с водой при нагревании или с помощью катализаторов.
Большинство металлов можно разделить на три категории в зависимости от реакции с водой: металлы, реакция которых протекает очень активно, металлы, реакция которых протекает медленно, и металлы, не реагирующие с водой.
Отношение кислорода и окисление
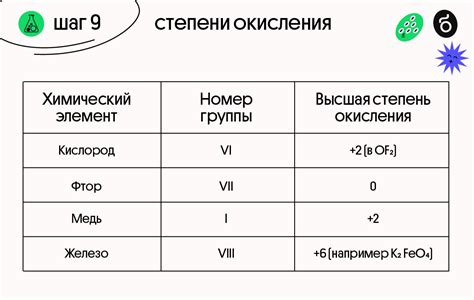
Кислород является одним из основных неметаллов, с которым взаимодействуют металлы. В результате взаимодействия с кислородом происходит процесс окисления, который может протекать с разной интенсивностью.
Окисление – это процесс, при котором металлы передают электроны атомам кислорода, что приводит к образованию соединений – оксидов. Оксиды металлов обладают различными свойствами и широко применяются в разных областях нашей жизни.
Взаимодействие металлов с кислородом может происходить различными способами: при нагревании, при взаимодействии с окружающей атмосферой или при контакте с кислородсодержащими реагентами.
Некоторые металлы, такие как железо или алюминий, окисляются при взаимодействии с кислородом, образуя оксиды, которые могут быть как стабильными, так и нестабильными. Например, оксид железа Fe2O3 является стабильным и широко распространенным в виде ржавчины на поверхности металла. В свою очередь, алюминий окисляется до оксида Al2O3, который обуславливает защитные свойства алюминия и предотвращает его дальнейшее окисление.
Другие металлы, такие как золото или платина, обладают высокой устойчивостью к окислению и не реагируют с кислородом. Это делает их очень ценными и используемыми в ювелирном и электронном производстве.
Реакция неметаллов с металлами
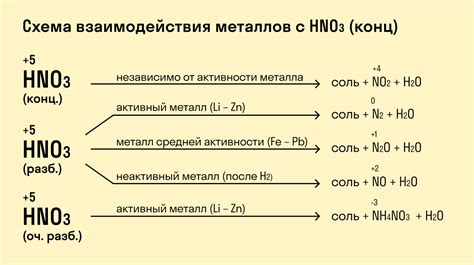
Реакция неметаллов с металлами является одной из основных форм взаимодействия веществ. Она основана на возможности неметаллов и металлов образовывать химические соединения при контакте друг с другом. Реакция неметаллов с металлами может быть как экзотермической (выделение тепла), так и эндотермической (поглощение тепла).
Первым главным аспектом в реакции неметаллов с металлами является возможность образования солей. Неметаллы обладают высокими электроотрицательностями, что позволяет им перенять электроны от металлов. Таким образом, образуются ионные соединения, представляющие собой соли. Примером такой реакции является образование хлорида натрия (NaCl) при взаимодействии натрия (Na) и хлора (Cl2).
Вторым важным аспектом реакции неметаллов с металлами является возможность образования ковалентных соединений. Ковалентная связь возникает при равномерном распределении электронов между неметаллом и металлом. Это может происходить, если у неметалла высокая электроотрицательность, а у металла низкая. Примером такой реакции является образование воды (H2O) при взаимодействии водорода (H2) и кислорода (O2).
Третьим важным аспектом в реакции неметаллов с металлами является возможность образования оксидов. Оксиды представляют собой соединения, состоящие из металла и кислорода. Реакция возникает, когда металл вступает в прямой контакт с кислородом, что приводит к образованию окиси металла. Примером такой реакции является образование оксида алюминия (Al2O3) при взаимодействии алюминия (Al) и кислорода (O2).
Инертность и возможные реакции
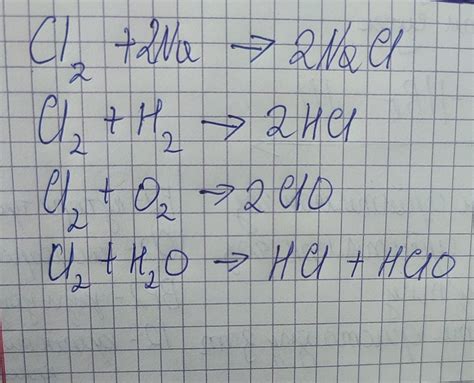
Между металлами и неметаллами возможны различные реакции, которые зависят от их химических свойств. Некоторые металлы, такие как золото, серебро и платина, обладают высокой инертностью и не реагируют с неметаллами или водой. Это связано с их стабильной электронной конфигурацией и высокой энергией ионизации.
Однако, большинство металлов имеют более низкую инертность и могут реагировать с неметаллами и водой. Например, металлы группы щелочных металлов, такие как натрий и калий, активно реагируют с водой, образуя гидроксиды и выделяя водород. Это связано с их низкой энергией ионизации и высокой реакционной способностью.
Металлы также могут реагировать с неметаллами, образуя различные соединения. Например, реакция между металлом алюминием и неметаллом кислородом приводит к образованию оксида алюминия. Это связано с тем, что металлы имеют способность отдавать электроны, а неметаллы - принимать электроны.
Интересной особенностью взаимодействия металлов с неметаллами и водой является возможность образования кислорода в результате реакции. Например, металлический магний может реагировать с водой, образуя гидроксид магния и выделяя молекулярный кислород. Это связано с его способностью расщеплять молекулы воды и выделять кислород.
Вопрос-ответ

Как происходит взаимодействие металлов с неметаллами и водой?
Взаимодействие металлов с неметаллами и водой может происходить различными способами в зависимости от химических свойств веществ. Например, реакция металла с неметаллом может привести к образованию соединения, таких как соли или оксиды. Взаимодействие с водой может привести к образованию гидроксидов или выделению водорода газа.
Какие основные аспекты и особенности взаимодействия металлов с неметаллами и водой?
Основные аспекты взаимодействия металлов с неметаллами и водой включают способность металла окисляться и передавать электроны неметаллу, образование новых соединений и выделение энергии. Особенности взаимодействия зависят от химических свойств веществ и могут приводить к образованию различных продуктов реакции.
