Оксиды щелочных металлов, таких как натрий, калий и литий, являются одними из самых распространенных химических соединений. Но что происходит, когда эти оксиды взаимодействуют с водой? Реакция оксидов щелочных металлов с водой является одним из наиболее известных и широко используемых химических процессов.
Суть данного процесса заключается в следующем: когда оксиды щелочных металлов, такие как оксид натрия (Na2O) или оксид калия (K2O), соприкасаются с водой (H2O), возникает реакция, в результате которой образуется гидроксид щелочного металла и высвобождается большое количество тепла.
Эта реакция может быть использована в самых различных областях. Например, гидроксид натрия (NaOH), получаемый в результате реакции оксида натрия с водой, широко применяется в производстве мыла, стекла, бумаги и других продуктов. Он также используется в качестве щелочи в процессах очистки воды и в производстве пищевых добавок.
Таким образом, реакция оксидов щелочных металлов с водой имеет огромное значение в промышленности и научных исследованиях, и является основой для многих химических процессов.
Оксиды щелочных металлов: общая характеристика

Оксиды щелочных металлов – это химические соединения, состоящие из атомов щелочных металлов и кислорода. Они обладают высокой степенью химической активности и широко применяются в различных областях.
Основная характеристика оксидов щелочных металлов заключается в их способности реагировать с водой, образуя щелочи. При этом происходит химическое превращение оксида и воды в гидроксид металла и выделение энергии в виде тепла. Такая реакция является экзотермической и сопровождается выделением газа – водорода.
Применение оксидов щелочных металлов включает многообразие областей, от бытовых до промышленных. Они широко используются в химической промышленности для производства щелочей, катализаторов, стекол и керамики. Оксиды щелочных металлов также используются в электрохимии, в процессе производства элементарного натрия и калия, а также в литий-ионных батареях.
Оксиды щелочных металлов обладают высокой химической активностью и реактивностью, что делает их важными компонентами в различных химических реакциях. Их уникальные свойства определяют их широкое применение в разных сферах человеческой деятельности и являются объектом активного изучения в научных исследованиях.
Процесс реакции оксидов щелочных металлов с водой
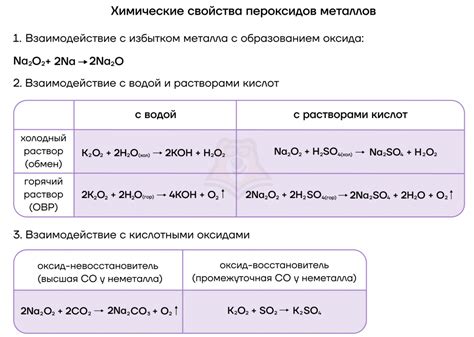
Реакция оксидов щелочных металлов с водой является знаковым процессом в химии. Оксиды щелочных металлов - это соединения, в которых кислород связан с металлом. Когда оксиды щелочных металлов взаимодействуют с водой, они проявляют себя как основания, образуя гидроксиды и высвобождая водород. Это процесс называется гидролизом.
Реакция оксида щелочного металла M2O с водой может представляться следующим уравнением:
M2O + H2O → 2MOH
Где M - щелочной металл, а MOH - гидроксид щелочного металла.
Процесс реакции оксидов щелочных металлов с водой имеет множество практических применений. Гидроксиды щелочных металлов, полученные в результате этой реакции, широко используются в различных отраслях промышленности и научных исследований.
Например, гидроксид натрия, полученный из реакции оксида натрия с водой, широко применяется в производстве стекла, моющих средств и щелочных аккумуляторов. Гидроксид калия, образующийся при взаимодействии оксида калия с водой, используется в производстве удобрений, мыла и косметических средств.
Важно отметить, что реакция оксидов щелочных металлов с водой является экзотермической, то есть сопровождается выделением тепла. Это может приводить к нагреванию реакционной смеси и требовать контроля температуры.
Химический состав и основные свойства получаемых соединений

Оксиды щелочных металлов реагируют с водой, образуя основания. Главным образом, они образуют гидроксиды щелочных металлов – соединения, содержащие металл, кислород и водород. Например, реакция натрия с водой приводит к образованию гидроксида натрия:
2Na + 2H2O → 2NaOH + H2
Гидроксид натрия – щелочное соединение, которое широко используется в промышленности. Оно является основным компонентом стекла, мыла и моющих средств. Благодаря своей щелочной природе, гидроксид натрия также используется в щелочных аккумуляторах, при изготовлении бумаги и текстиля, в электроде при электролизе воды и других процессах.
Как правило, гидроксиды щелочных металлов растворяются в воде и образуют алкалии. Алкалии - водные растворы, обладающие выраженными щелочными свойствами. Кроме гидроксидов, щелочные металлы образуют также другие соединения, например, пероксиды и гидрокарбонаты.
Гидрокарбонаты или бикарбонаты щелочных металлов – это соединения, которые образуются при реакции оксидов с углекислым газом в водной среде. Например, оксид калия и углекислый газ реагируют с водой, образуя гидрокарбонат калия:
K2O + CO2 + H2O → 2KHCO3
Гидрокарбонат калия, известный также как пищевая сода, широко используется в пищевой промышленности, для приготовления пищи и выпечки, а также в бытовых условиях для очистки и укрепления зубов.
Физические и химические свойства щелочных металлов
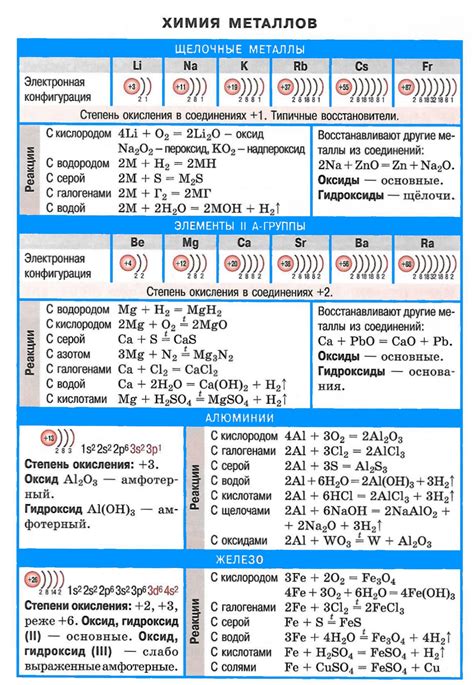
Щелочные металлы — это элементы периодической системы, которые входят в первую группу: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У них есть ряд характерных физических и химических свойств.
Физические свойства:
1. Мягкость: Щелочные металлы являются самыми мягкими металлами в периодической системе. Они могут быть разрезаны ножом или нарезаны ножницами.
2. Низкая плотность: Они имеют низкую плотность, что делает их легкими и подвижными.
3. Низкая температура плавления: Щелочные металлы имеют низкую температуру плавления, что означает, что они могут быть легко плавлены и применяются в различных промышленных процессах.
Химические свойства:
1. Активность: Щелочные металлы являются очень активными химическими элементами. Они быстро окисляются воздухом и реагируют с водой, образуя гидроксиды щелочных металлов и высвобождая водород.
2. Реакция с кислотами: Щелочные металлы реагируют с кислотами, образуя соли и высвобождая водород. Это реакция нейтрализации.
3. Образование солей: Щелочные металлы образуют соли с различными кислотами. Соли с щелочными металлами широко используются в различных сферах, включая пищевую, фармацевтическую и химическую промышленности.
4. Цветные огни: Щелочные металлы, такие как литий, натрий и калий, дают характерные яркие цвета при горении. Это свойство используется в различных пиротехнических элементах.
Таблица свойств щелочных металлов:
| Элемент | Атомный номер | Атомная масса | Температура плавления (°C) | Температура кипения (°C) |
|---|---|---|---|---|
| Литий (Li) | 3 | 6,941 | 180,54 | 1347 |
| Натрий (Na) | 11 | 22,990 | 97,72 | 883 |
| Калий (K) | 19 | 39,098 | 63,38 | 759 |
| Рубидий (Rb) | 37 | 85,468 | 38,89 | 688 |
| Цезий (Cs) | 55 | 132,905 | 28,44 | 678 |
| Франций (Fr) | 87 | 223,0 | 27 | 677 |
Таким образом, физические и химические свойства щелочных металлов делают их важными и широко применяемыми в различных отраслях промышленности и науки.
Применение соединений, получаемых в результате реакции

Реакция оксидов щелочных металлов с водой ведет к образованию соединений, которые нашли широкое применение в различных областях науки и промышленности.
Гидроксиды щелочных металлов, получаемые в результате реакции оксидов щелочных металлов с водой, являются основными веществами и используются в процессе нейтрализации кислых растворов. Они применяются в химической промышленности для производства различных химических соединений, в процессе очистки воды, а также в фармацевтической и пищевой промышленности.
Гидроксид калия (каустическая сода) используется в текстильной промышленности для обработки и отбеливания тканей, а также в производстве мыла и моющих средств.
Гидроксид натрия (известный также как каустическая сода) широко применяется в производстве бумаги, стекла, мыла, алюминия и других металлов. Он также используется в химической и нефтеперерабатывающей промышленности, а также в процессе очистки воды и сточных вод.
Гидроксид лития применяется в производстве легких конструкционных материалов, литий-ионных аккумуляторов, стекол и фармацевтических препаратов.
Таким образом, соединения, получаемые в результате реакции оксидов щелочных металлов с водой, имеют широкое применение и играют важную роль в различных областях человеческой деятельности.
Примеры использования соединений в промышленности

Соединения щелочных металлов, такие как гидроксид натрия и гидроксид калия, широко используются в различных отраслях промышленности.
Одним из основных применений этих соединений является их использование в процессе сапонификации, который применяется в производстве мыла и моющих средств. Гидроксид натрия играет ключевую роль в превращении природных жиров и масел в мыльные основы.
Щелочные металлы также широко применяются в стекольной промышленности. Они служат основными компонентами для производства стекла, обеспечивая его прозрачность, прочность и устойчивость к химическим реакциям. Гидроксид натрия применяется в процессе стеклования, а карбонат натрия применяется для понижения температуры плавления и снижения вязкости стеклянной массы.
Соединения щелочных металлов также находят применение в производстве бумаги и целлюлозы. Гидроксид натрия используется для обработки древесины, чтобы из нее извлечь целлюлозу, которая затем превращается в бумагу. Кроме того, гидроксид натрия используется в процессе отбеливания целлюлозы, что позволяет получить белую бумагу.
Другим примером использования соединений щелочных металлов является их применение в производстве пищевых продуктов. Гидроксид натрия используется в процессе дегидратации и нейтрализации различных пищевых ингредиентов. Карбонат натрия применяется для регулирования pH и улучшения текстуры пищевых продуктов.
Влияние реакции оксидов на окружающую среду

Реакция оксидов щелочных металлов с водой имеет значительное влияние на окружающую среду и обладает как положительными, так и отрицательными последствиями.
Положительным аспектом этой реакции является возможность получения важных химических соединений на основе щелочных металлов. Например, реакция оксида натрия с водой приводит к образованию гидроксида натрия, который широко используется в бытовой химии, производстве стекла и мыла. Гидроксид натрия также является важным компонентом щелочных батарей и моющих средств.
Однако реакция оксидов с водой может иметь и негативные последствия для окружающей среды. Во-первых, в результате этой реакции образуется гидроксид металла, который считается токсичным в больших концентрациях. При попадании водных растворов гидроксидов щелочных металлов в природные водоемы или почву происходит загрязнение окружающей среды и нарушается биологическое равновесие в экосистемах.
Кроме того, реакция оксидов щелочных металлов с водой сопровождается выделением значительного количества теплоты. Это явление известно как экзотермическая реакция. Высокотемпературные условия на месте реакции могут привести к возникновению пожара или даже взрыва, что представляет опасность не только для окружающей среды, но и для жизни и здоровья людей.
Для минимизации отрицательного воздействия реакции оксидов на окружающую среду необходимо учитывать и контролировать процессы их образования и использования. Разработка и применение экологически безопасных технологий и методов утилизации отходов играют важную роль в сохранении природных ресурсов и охране окружающей среды.
Вопрос-ответ

Какие оксиды щелочных металлов реагируют с водой?
Оксиды щелочных металлов, такие как натрий (Na2O), калий (K2O) и литий (Li2O), реагируют с водой, образуя соответствующие гидроксиды щелочных металлов (например, NaOH, KOH и LiOH).
В чем суть реакции оксидов щелочных металлов с водой?
В ходе реакции оксиды щелочных металлов с водой реагируют, образуя соответствующие гидроксиды. В это время, оксиды высвобождают кислородные атомы, которые затем соединяются с молекулами воды, образуя гидроксиды. Например, оксид натрия (Na2O) реагирует с водой (H2O), образуя гидроксид натрия (NaOH).
Каково применение реакции оксидов щелочных металлов с водой?
Реакция оксидов щелочных металлов с водой широко используется в промышленности и лабораторных условиях. Гидроксиды щелочных металлов, образованные в результате этой реакции, используются в качестве щелочей и фундаменталных компонентов в процессах производства многих химических соединений. Например, гидроксид натрия (NaOH), также известный как каустическая сода, используется в производстве стекла, мыла, бумаги и многих других продуктов. Кроме того, гидроксиды щелочных металлов также используются в жидкостях для очистки, дезинфицирования и нейтрализации кислоты.
