Оксиды щелочноземельных металлов являются одними из наиболее распространенных соединений, которые используются в различных отраслях науки и промышленности. Их химические свойства постоянно вызывают интерес у исследователей, однако существует множество мифов и ложных представлений о их взаимодействии с водой.
Одним из таких мифов является утверждение о реакции оксидов щелочноземельных металлов с водой, приводящей к немедленному и взрывоопасному выделению газов. В действительности, взаимодействие между оксидами щелочноземельных металлов и водой происходит гораздо менее стремительно и спокойно.
Оксиды щелочноземельных металлов, такие как оксид кальция или оксид магния, обычно не растворяются в воде, поэтому их взаимодействие с водой происходит при контакте с ее поверхностью. В результате реакции оксида с водой образуются основания, а не газы. Поэтому суждения о взрывной природе этого процесса являются ошибочными и не соответствуют действительности.
Тем не менее, взаимодействие оксидов щелочноземельных металлов с водой может быть достаточно интенсивным и приводить к выделению значительного количества тепла. Поэтому при работе с этими соединениями необходимо соблюдать особую осторожность и использовать соответствующие защитные меры. Знание и понимание реальной природы взаимодействия оксидов щелочноземельных металлов с водой позволит избежать ошибок и несчастных случаев в химической лаборатории или промышленных установках.
Мифы о взаимодействии оксидов щелочноземельных металлов с водой
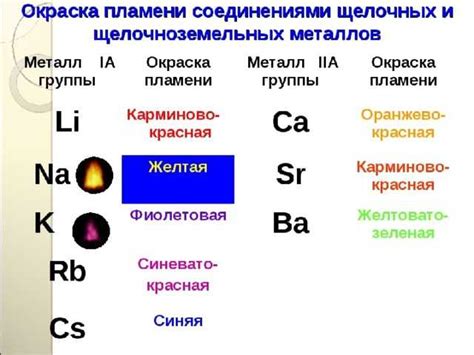
Миф 1: Оксиды щелочноземельных металлов полностью растворяются в воде.
На самом деле, оксиды щелочноземельных металлов, такие как оксид кальция и оксид магния, обладают низкой растворимостью в воде. При контакте с водой они образуют гидроксиды, но процесс растворения происходит не мгновенно. Растворение оксидов щелочноземельных металлов в воде является химической реакцией, которая требует времени.
Миф 2: Взаимодействие оксидов щелочноземельных металлов с водой происходит безопасно.
Процесс взаимодействия оксидов щелочноземельных металлов с водой может быть опасным в некоторых случаях. Например, при добавлении достаточного количества сильных щелочей, таких как оксид кальция, в большое количество воды, может произойти высвобождение большого количества тепла, что может привести к опасному повышению температуры. Поэтому важно соблюдать меры предосторожности при работе с оксидами щелочноземельных металлов и водой.
Миф 3: Оксиды щелочноземельных металлов не образуют основания при взаимодействии с водой.
При взаимодействии оксидов щелочноземельных металлов с водой, образуется гидроксид металла, который является основанием. Гидроксиды щелочноземельных металлов имеют высокую щелочность и могут использоваться как антациды для нейтрализации кислотности в желудке.
Миф 4: Взаимодействие оксидов щелочноземельных металлов с водой не имеет практического значения.
Взаимодействие оксидов щелочноземельных металлов с водой имеет практическое значение во многих отраслях. Например, гидроксид кальция, полученный при взаимодействии оксида кальция с водой, используется в строительной и фармацевтической промышленности. Оксид магния также широко используется в качестве антиокислителя и добавки в пищевую промышленность.
Оксиды щелочноземельных металлов - безобидные вещества
Оксиды щелочноземельных металлов являются важными соединениями, которые обладают различными свойствами и широко применяются в промышленности. Они представляют собой неорганические соединения состоящие из атомов щелочноземельных металлов и кислорода.
Оксиды щелочноземельных металлов обычно кристаллические вещества, хорошо растворяющиеся в воде и образующие щелочные растворы. Они могут быть использованы в качестве катализаторов, в производстве стекла, керамики и различных электронных устройств. Кроме того, они широко используются в медицине и фармакологии как антациды и лекарственные препараты.
Взаимодействие оксидов щелочноземельных металлов с водой обычно проходит безопасно. Отдельные случаи могут вызывать реакцию с выделением тепла и образованием щелочных растворов. Однако, при соблюдении мер предосторожности, таких как ношение защитной экипировки и вентиляция помещения, взаимодействие оксидов с водой не представляет опасности для здоровья и окружающей среды.
В заключение, оксиды щелочноземельных металлов являются безобидными веществами с множеством полезных свойств и применений. Хотя с ними необходимо обращаться осторожно и соблюдать меры предосторожности при взаимодействии с водой, их широкое использование в различных отраслях промышленности и медицине свидетельствует о их важности и безопасности.
Оксиды щелочноземельных металлов вызывают взрывы при контакте с водой
Некоторые люди считают, что оксиды щелочноземельных металлов вызывают взрывы при контакте с водой. Однако это миф, который не соответствует реальности.
Оксиды щелочноземельных металлов, такие как оксид магния или оксид кальция, обладают химической активностью, но их взаимодействие с водой не ведет к взрывам. Оксиды щелочноземельных металлов просто реагируют с водой, образуя гидроксиды и выделяя тепло.
В процессе реакции оксид щелочноземельного металла с водой происходит образование гидроксида металла и выделение тепла. Гидроксиды щелочноземельных металлов обладают щелочными свойствами, поэтому образуется щелочная среда. Выделяющееся тепло можно ощутить, когда оксиды щелочноземельных металлов растворяются в воде.
Важно отметить, что при проведении экспериментов с оксидами щелочноземельных металлов и водой необходимо соблюдать меры предосторожности, так как реакция может быть интенсивной. Риски и возможность получения взрыва могут возникнуть только при неправильном обращении с веществами или при наличии особых условий, например, при большом количестве вещества и его концентрации.
Вывод: оксиды щелочноземельных металлов не вызывают взрывов при контакте с водой, однако реакция может быть интенсивной и сопровождаться выделением тепла. При правильном обращении и соблюдении мер предосторожности, взрывы можно избежать.
Способы безопасного взаимодействия оксидов щелочноземельных металлов с водой

Взаимодействие оксидов щелочноземельных металлов с водой может быть опасным и требует проявления осторожности. Чтобы обезопасить данное взаимодействие, можно использовать несколько способов.
Во-первых, необходимо выполнять работу с оксидами щелочноземельных металлов в хорошо проветриваемых помещениях или в специальных вытяжных шкафах. Это поможет избежать вдыхания вредных паров и обеспечит отвод опасных газов.
Во-вторых, при работе с оксидами щелочноземельных металлов важно использовать специальные индивидуальные защитные средства, такие как защитные очки, перчатки и халаты. Это поможет защитить кожу и глазы от химического воздействия оксидов.
Кроме того, при взаимодействии оксидов щелочноземельных металлов с водой необходимо соблюдать осторожность и следовать инструкциям производителя. Это позволит избежать возможных аварийных ситуаций и обеспечить безопасную работу.
Также может быть полезно иметь под рукой средства для нейтрализации и остановки реакции при необходимости. Это позволит быстро прервать взаимодействие оксидов с водой в случае возникновения опасной ситуации.
В целом, соблюдение предосторожностей при работе с оксидами щелочноземельных металлов и водой является необходимым условием для безопасного взаимодействия. Это поможет избежать возможных опасностей и обеспечит успешное выполнение работы.
Реакции оксидов щелочноземельных металлов с водой
Оксиды щелочноземельных металлов являются соединениями, которые могут вступать в реакцию с водой. При взаимодействии с водой оксиды щелочноземельных металлов образуют гидроксиды, происходит гидратация молекулы оксида и образование воды. Реакции воды с оксидами щелочноземельных металлов происходят с выделением большого количества тепла.
В результате реакции оксидов щелочноземельных металлов с водой образуются щелочные растворы (гидроксиды), которые имеют щелочную реакцию. Например, оксид кальция (CaO) при добавлении к воде образует гидроксид кальция (Ca(OH)2), который является основанием. Величина pH щелочного раствора, образованного при реакции оксида щелочноземельного металла с водой, зависит от концентрации гидроксида в растворе.
Реакции оксидов щелочноземельных металлов с водой также происходят при образовании газовых продуктов. Например, оксид магния (MgO) при взаимодействии с водой образует гидроксид магния (Mg(OH)2) и выделяет молекулы газообразного водорода (H2). Образование газовых продуктов является одной из характеристик реакции оксида с водой.
Реакции оксидов щелочноземельных металлов с водой происходят быстро и их скорость зависит от многих факторов, включая концентрацию оксида, температуру и давление. Реакции с водой оксидов щелочноземельных металлов широко изучаются и имеют практическое значение в различных областях науки и промышленности.
Практическое применение оксидов щелочноземельных металлов

Оксиды щелочноземельных металлов, такие как оксид кальция (CaO), оксид магния (MgO), оксид бария (BaO) и другие, имеют широкое практическое применение в различных отраслях.
Строительная отрасль: Оксиды щелочноземельных металлов используются в производстве строительных материалов. Например, оксид кальция широко применяется при производстве цемента и строительных растворов. Он используется как активный компонент при смешивании с водой, создавая химическую реакцию, которая приводит к твердению раствора и образованию каменной массы. Оксид магния также используется в строительстве, особенно при производстве огнеупорных материалов.
Производство стекла: Оксид кальция широко применяется в производстве стекла. Он является одним из основных компонентов стекла и обеспечивает его прочность и устойчивость к повреждениям. Оксид магния также используется при производстве некоторых видов стекла, таких как огнеупорное стекло.
Производство удобрений: Оксид кальция и оксид магния часто используются в производстве удобрений для обогащения почвы необходимыми микроэлементами. Они помогают регулировать pH-уровень почвы и обеспечивают растения необходимыми минералами для их здорового роста.
Производство пищевых добавок: Оксиды щелочноземельных металлов могут использоваться в производстве пищевых добавок, таких как стабилизаторы и консерванты. Они могут способствовать сохранению пищевых продуктов и улучшать их хранение.
Таким образом, оксиды щелочноземельных металлов имеют широкое применение в различных отраслях, от строительной и стекольной промышленности до производства удобрений и пищевых добавок. Их химические свойства и способность взаимодействовать с водой делают их важными компонентами во многих процессах и применениях.
Вопрос-ответ

Взаимодействуют ли оксиды щелочноземельных металлов с водой?
Да, оксиды щелочноземельных металлов взаимодействуют с водой, образуя гидроксиды этих металлов. При этом происходит химическая реакция, в результате которой образуется гидроксид и выделяется тепло.
Какова реальность взаимодействия оксидов щелочноземельных металлов с водой?
Реальность состоит в том, что оксиды щелочноземельных металлов действительно реагируют с водой и образуют гидроксиды. Это химическое взаимодействие может быть использовано в различных процессах, например, для получения щелочей или производства газов.
Какие мифы связаны с взаимодействием оксидов щелочноземельных металлов с водой?
Один из распространенных мифов заключается в том, что вода может просто испариться при контакте с оксидами щелочноземельных металлов. Это не верно, так как при взаимодействии оксидов с водой происходит реакция, и вода превращается в гидроксид металла, а не просто испаряется.
Каков механизм взаимодействия оксидов щелочноземельных металлов с водой?
Механизм взаимодействия заключается в том, что оксиды щелочноземельных металлов диссоциируют в воде, образуя гидроксиды и выделение тепла. Диссоциация происходит из-за активности металла, который реагирует с водой и образует гидроксид, в результате чего освобождается энергия.
