Оксиды щелочноземельных металлов – это соединения, состоящие из атомов щелочноземельного металла и кислорода. Щелочноземельные металлы включают в себя бериллий, магний, кальций, стронций, барий и радий. Оксиды щелочноземельных металлов обладают различными свойствами и находят применение в различных сферах науки и промышленности.
Одним из наиболее известных оксидов щелочноземельных металлов является оксид магния, химическая формула которого MgO. Этот соединение имеет высокую температуру плавления и кипения, а также отличается высокой твердостью и электроотрицательностью. Оксид магния широко используется в производстве керамики, электрических изоляторов и огнеупорных материалов.
Оксид бериллия (BeO) является другим важным представителем оксидов щелочноземельных металлов. Он обладает высокой теплопроводностью, электроизоляционными свойствами и химической инертностью. Оксид бериллия находит широкое применение в производстве ядерных реакторов, электроники и промышленных катализаторов.
Оксид кальция (CaO) известен под названием известняка и является одним из наиболее распространенных минералов в земной коре. Этот оксид обладает щелочными свойствами и применяется в производстве цемента, стекла, шлака и других строительных материалов. Оксид кальция также используется в сельском хозяйстве в качестве пестицида и добавки в корма для животных.
Оксиды щелочноземельных металлов имеют широкий спектр применения в различных отраслях. Они являются важными компонентами в производстве керамики, электроники, строительных материалов и других продуктов. Кроме того, эти соединения имеют существенное значение в химической и фармацевтической промышленности.
Определение и свойства оксидов щелочноземельных металлов
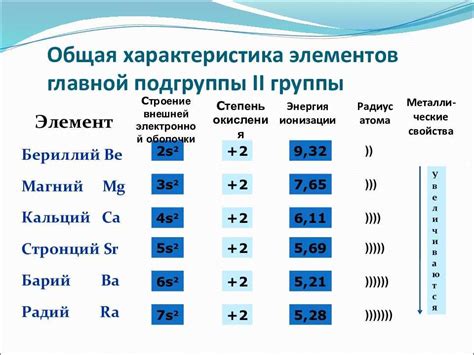
Оксиды щелочноземельных металлов - это химические соединения, состоящие из атомов щелочноземельных металлов и кислорода. Они обладают различными свойствами и широко применяются в различных отраслях промышленности.
Основные свойства оксидов щелочноземельных металлов включают:
- Жесткость: оксиды щелочноземельных металлов обычно являются твердыми веществами с высокой температурой плавления.
- Химическая активность: оксиды щелочноземельных металлов реагируют с водой, образуя основания, и с кислородом, образуя пероксиды.
- Электропроводность: некоторые оксиды щелочноземельных металлов обладают электропроводностью и используются в электронике и электротехнике.
- Цветность: некоторые оксиды щелочноземельных металлов обладают яркими цветами, что делает их полезными в качестве пигментов и красителей.
- Растворимость: некоторые оксиды щелочноземельных металлов растворяются в воде, образуя щелочные растворы, которые широко используются в химической промышленности.
Примеры оксидов щелочноземельных металлов включают оксид кальция (CaO), оксид магния (MgO), оксид бария (BaO) и оксид стронция (SrO). Они играют важную роль в различных отраслях промышленности, включая стекольную, металлургическую и керамическую.
В заключении следует отметить, что оксиды щелочноземельных металлов являются важными химическими соединениями, обладающими различными свойствами и широким спектром применения.
Оксиды щелочноземельных металлов в природе

Оксиды щелочноземельных металлов встречаются в природе в большом количестве и имеют разнообразные свойства. Они образуются при взаимодействии металлов с кислородом и являются основными составными элементами земной коры.
Самым распространенным оксидом щелочноземельных металлов является оксид кальция, известный также как известь или известняк. Он образуется при горении кальция в воздухе и широко используется в строительстве, производстве стекла и цемента.
Оксиды магния и бериллия также встречаются в природе. Они обладают высокой теплопроводностью и используются в производстве огнеупорных материалов, электрических изоляторов и смазочных материалов.
Оксиды стронция и бария используются в производстве лакокрасочных материалов, керамики, электроники и химической промышленности. Оксид бария, например, применяется в производстве стекла для телевизионных экранов и рентгеновских трубок.
Большое значение имеют также оксиды редких металлов, таких как оксиды иттрия, лантана, церия и др. Они используются в производстве различных видов катализаторов, магнитов, полупроводников и других технических материалов.
Физические свойства оксидов щелочноземельных металлов

Оксиды щелочноземельных металлов являются соединениями, состоящими из атомов металла и кислорода. Они обладают рядом характерных физических свойств, которые определяются их структурой и составом.
Первое физическое свойство оксидов щелочноземельных металлов - это их цвет. В зависимости от состава и структуры, оксиды щелочноземельных металлов могут иметь различные цвета. Например, оксид кальция (известный также как известняк) имеет белый цвет, оксид магния (магнезит) - белый или серый, оксид стронция (странций) - белый. Однако, некоторые оксиды щелочноземельных металлов могут иметь и другие цвета, например, оксид бария (барийна зелень) - зеленый цвет, оксид циркония (циркон) - желтый, красный или коричневый.
Второе физическое свойство оксидов щелочноземельных металлов - их плотность. Оксиды щелочноземельных металлов обычно обладают высокой плотностью. Например, плотность оксида кальция составляет около 3,34 г/см³, плотность оксида магния - около 2,98 г/см³, плотность оксида стронция - около 4,7 г/см³. Однако, плотность может варьироваться в зависимости от структуры и состава конкретного оксида.
Третьим физическим свойством оксидов щелочноземельных металлов является их температура плавления. Оксиды щелочноземельных металлов имеют высокую температуру плавления. Например, температура плавления оксида кальция составляет около 2572 °C, оксида магния - около 2800 °C, оксида стронция - около 2430 °C. Это свойство определяет их возможность использования в различных технологических процессах и высокотемпературных приборах.
Химические свойства оксидов щелочноземельных металлов

Оксиды щелочноземельных металлов являются основными оксидами, поскольку они образуются при соединении металлов с кислородом. Они обладают высокой щелочностью и способны реагировать с кислотами, образуя соли и воду.
Оксиды щелочноземельных металлов обычно представляют собой кристаллические соединения, которые имеют высокую температуру плавления и низкую растворимость в воде. Они обладают электропроводностью и способны проводить ток, когда на них действует электрическое поле.
Оксиды щелочноземельных металлов являются химически активными соединениями и способны реагировать с различными веществами. Например, они могут реагировать с водой, образуя щелочные растворы. Также они могут реагировать с кислотами, диоксидами и другими оксидами, образуя соли и воду.
Химические свойства оксидов щелочноземельных металлов зависят от их состава и структуры. Например, оксид кальция (CaO) обладает высокой растворимостью в воде и используется в производстве цемента и стекла. Оксид магния (MgO) имеет высокую температуру плавления и используется в производстве огнеупорных материалов.
В целом, оксиды щелочноземельных металлов являются важными соединениями, которые имеют широкое применение в различных отраслях промышленности и науки. Изучение их свойств позволяет понять особенности работы этих веществ и использовать их в различных процессах.
Примеры оксидов щелочноземельных металлов

Оксиды щелочноземельных металлов являются соединениями, образованными металлами из группы щелочноземельных элементов и кислородом. Они обладают химической формулой MO, где M представляет собой металл из группы щелочноземельных элементов.
Примером оксида щелочноземельного металла является оксид кальция (CaO). Этот оксид известен также как известь или едкий кустарник и широко используется в производстве строительных материалов и в качестве добавки в пищевую промышленность.
Еще одним примером оксида щелочноземельного металла является оксид магния (MgO), который также известен как магниевая известь или пергунтус. Он широко применяется в производстве стекла, керамики, огнеупорных материалов и в медицине.
Оксид бария (BaO) также является примером оксида щелочноземельного металла. Этот оксид используется в производстве электронных приборов, стекла, красителей и катализаторов, а также в медицине в качестве контрастного вещества для рентгеновских исследований.
Другим примером оксида щелочноземельного металла является оксид стронция (SrO). Этот оксид применяется в производстве электронных компонентов, светоизлучающих диодов, радиоактивных лечебных исследований и в жаропрочной керамике.
Таким образом, оксиды щелочноземельных металлов имеют широкий спектр применения и играют важную роль в различных отраслях промышленности и науке.
Применение оксидов щелочноземельных металлов в промышленности
Оксиды щелочноземельных металлов, такие как оксид кальция (CaO), оксид магния (MgO) и оксид бария (BaO), имеют широкое применение в различных отраслях промышленности.
Стекольная промышленность: Оксиды щелочноземельных металлов используются для производства стекла. Оксид кальция, известный также как известняк или известь, используется в качестве основного компонента для производства стекла. Оксид магния добавляется в стеклянную массу для улучшения ее химической стойкости и механических свойств. Оксид бария используется для улучшения оптических свойств стекла, таких как прозрачность и преломление света.
Металлургическая промышленность: Оксиды щелочноземельных металлов находят широкое применение в металлургии. Оксид кальция используется как флюс для удаления примесей из металлического расплава и снижения температуры плавления. Оксид магния применяется в качестве графитного материала для легирования стали. Оксид бария используется для удаления кислорода из металла и снижения содержания серы.
Химическая промышленность: Оксиды щелочноземельных металлов используются в процессах синтеза и каталитических реакциях. Оксид кальция используется в производстве цемента, извести и карбида кальция. Оксид магния применяется в производстве огнеупорных материалов, магниевых сплавов и магнииорганических соединений. Оксид бария используется в качестве катализатора в химических реакциях.
Кроме того, оксиды щелочноземельных металлов используются в производстве электротехнических изделий, строительных материалов, косметических и фармацевтических препаратов, пищевых добавок и других продуктов промышленности.
Вопрос-ответ

Зачем нужно изучать оксиды щелочноземельных металлов?
Изучение оксидов щелочноземельных металлов является важной задачей в области химии и материаловедения. Оксиды щелочноземельных металлов имеют широкий спектр применений, включая производство стекол и керамики, катализаторов, добавок для полимеров, солнечных элементов и многого другого. Они также служат важными компонентами в различных химических реакциях и процессах. Изучение свойств и способов взаимодействия оксидов щелочноземельных металлов позволяет улучшить их технологические свойства и расширить спектр их применения.
Какие примеры оксидов щелочноземельных металлов можно привести?
Примерами оксидов щелочноземельных металлов являются оксиды магния (MgO), кальция (CaO), стронция (SrO) и бария (BaO). Они характеризуются высоким плавлением, твердостью и стабильностью при высоких температурах. Оксид магния (MgO) обладает отличными теплоизоляционными свойствами и применяется в производстве огнеупорных материалов и стекол. Оксид кальция (CaO) используется в производстве цемента и животноводстве в качестве дезинфицирующего средства. Оксиды стронция (SrO) и бария (BaO) используются в электронике, в том числе в производстве катодов для вакуумных трубок и радиоэлектронных компонентов.
Какие свойства характерны для оксидов щелочноземельных металлов?
Оксиды щелочноземельных металлов обладают рядом характерных свойств. Во-первых, они обычно обладают высокой твердостью и стабильностью при высоких температурах. Во-вторых, они имеют высокую теплоемкость и отличные теплоизоляционные свойства, что делает их полезными в различных областях, связанных с высокими температурами. В-третьих, оксиды щелочноземельных металлов могут обладать каталитической активностью и использоваться в различных химических реакциях. И, наконец, они могут иметь определенные электронные свойства, что делает их полезными в электронике и фотоэлектрических устройствах.
