Оксиды переходных металлов являются химическими соединениями, состоящими из атома переходного металла и атомов кислорода. Эти соединения в основном обладают сложной структурой и разнообразными физико-химическими свойствами. Оксиды переходных металлов широко распространены в природе и используются во многих отраслях промышленности.
Одной из основных характеристик оксидов переходных металлов является их способность к катализу. Они способны активировать химические реакции путем изменения их кинетики и активации реакционных центров. Катализ оксидами переходных металлов может происходить как на поверхности материала, так и внутри его структуры.
Оксиды переходных металлов также обладают электрохимическими свойствами, которые позволяют им использоваться в различных электрохимических устройствах. Например, некоторые оксиды могут служить как аноды или катоды в аккумуляторах или суперконденсаторах. Благодаря своим свойствам оксиды переходных металлов играют важную роль в различных энергетических системах и устройствах.
Важной особенностью оксидов переходных металлов является их способность к образованию квазикристаллических структур. Квазикристаллы представляют собой трехмерные структуры, которые обладают периодичностью в двух или более направлениях, но без периодичности в третьем направлении. Оксиды переходных металлов могут образовывать квазикристаллические структуры, что делает их уникальными и интересными объектами для изучения и применения в различных областях науки и технологии.
Оксиды переходных металлов
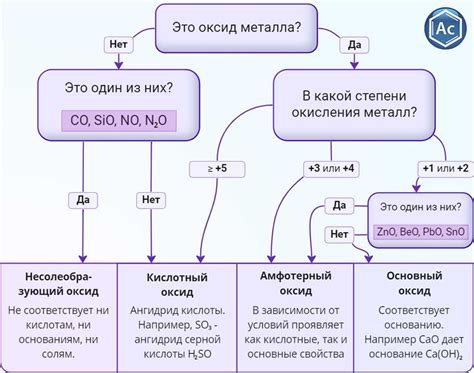
Оксиды переходных металлов — это соединения, состоящие из атомов оксида и атомов переходного металла. Оксиды переходных металлов обладают разнообразными физико-химическими свойствами и находят широкое применение в различных отраслях промышленности.
Переходные металлы образуют большое количество оксидов с разными степенями окисления. Некоторые из них имеют квадратную или кубическую кристаллическую решетку, а другие обладают амфотерными свойствами. Это позволяет оксидам переходных металлов проявлять разнообразные реакционные способности и обладать интересными свойствами.
Оксиды переходных металлов широко используются в каталитических процессах, применении для получения железа, производства керамики, стекла, электродов для батарей, фотоматериалов и других отраслях промышленности. Они также играют важную роль в химических реакциях, таких как окислительно-восстановительные процессы и реакции присоединения групп.
Важно отметить, что оксиды переходных металлов обладают различными электронными и магнитными свойствами, а также способностью к ферромагнетизму и антиферромагнетизму. Изучение этих составов и их свойств является актуальной задачей в современной науке и технологии.
Свойства
Оксиды переходных металлов обладают рядом уникальных свойств, которые делают их полезными в различных областях химии и промышленности. Они обычно имеют высокую температуру плавления и кипения, что делает их термоустойчивыми и позволяет использовать их в высокотемпературных реакциях и процессах. Однако, некоторые оксиды переходных металлов, такие как оксид железа (III), обладают низкой температурой плавления и используются в различных смазочных средствах.
Оксиды переходных металлов обладают также различными электронными свойствами, такими как проводимость или полупроводимость. Некоторые оксиды, такие как оксид цинка, обладают полупроводниковыми свойствами и находят применение в электронике и солнечных батареях.
Некоторые оксиды переходных металлов обладают каталитическими свойствами, что делает их полезными в химической промышленности. Например, оксид железа используется в катализаторах для преобразования газовых веществ, а оксид ванадия - в катализаторах для процессов окисления и дегидрирования органических соединений.
Применение

Оксиды переходных металлов имеют широкое применение в различных сферах.
В катализе оксиды переходных металлов играют важную роль. Они могут использоваться как гетерогенные катализаторы в химической промышленности. Например, оксиды меди, железа и цинка используются в процессе гетерогенного катализа при производстве аммиака, метанола и других веществ.
Оксиды переходных металлов также применяются в электронике и электротехнике. Например, оксиды меди, никеля и кобальта используются в производстве электронных компонентов, таких как транзисторы и диоды.
В качестве пигментов оксиды переходных металлов используются в производстве красок, керамики и стекла. Например, оксиды железа, титана и марганца придают красивые оттенки различным материалам.
Оксиды переходных металлов также используются в медицине. Некоторые из них имеют антибактериальные свойства и могут применяться в лечении инфекций. Кроме того, оксиды меди и цинка широко используются в косметической промышленности, входя в состав средств по уходу за кожей.
В производстве аккумуляторов и солнечных батарей также применяются оксиды переходных металлов. Их использование позволяет увеличить эффективность преобразования энергии и увеличить срок службы устройств.
Роль в химических реакциях
Оксиды переходных металлов играют важную роль в химических реакциях благодаря своим уникальным свойствам и структуре. Взаимодействуя с другими веществами, оксиды переходных металлов могут проявлять как окислительные, так и восстановительные свойства.
Один из основных типов химических реакций, где оксиды переходных металлов выступают в качестве активных участников, это реакции окисления и восстановления. В данных реакциях оксиды переходных металлов могут переходить из одного степени окисления в другую.
Благодаря своей структуре и свойствам, оксиды переходных металлов могут каталитически активировать химические реакции. Они могут повысить скорость реакции, снизить активационную энергию и улучшить выход продуктов. Поэтому оксиды переходных металлов широко применяются в промышленности для производства различных веществ, включая пластмассы, фармацевтические препараты, катализаторы и многое другое.
Кроме того, оксиды переходных металлов могут быть использованы в электрохимических реакциях, таких как электролиз, гальваническая коррозия и аккумуляция энергии. Они способны обменять электроны с другими веществами и обеспечивать поток электрического тока. Благодаря этому, оксиды переходных металлов находят применение в батареях, солнечных батареях и других электрохимических устройствах.
Вопрос-ответ

Какие свойства имеют оксиды переходных металлов?
Оксиды переходных металлов обладают различными свойствами, в зависимости от металла, с которым они сочетаются. Однако, в общем случае, они являются химически активными соединениями, могут образовывать соли и взаимодействовать с другими веществами. Они обладают высокой термической и электрической проводимостью, а также имеют способность менять свою окислительную способность в химических реакциях.
В каких областях применяются оксиды переходных металлов?
Оксиды переходных металлов широко применяются в различных областях науки и техники. Например, они используются в качестве катализаторов в промышленности для ускорения химических реакций. Оксиды переходных металлов также применяются в электронике и солнечных панелях для создания полупроводниковых материалов. Кроме того, они находят применение в медицине, при производстве красителей и пигментов, а также в производстве стекла и керамики.
Какую роль выполняют оксиды переходных металлов в химических реакциях?
Оксиды переходных металлов играют важную роль в химических реакциях. Они могут выступать как окислителями, принимая электроны от веществ, с которыми взаимодействуют. Также они могут выступать в качестве катализаторов, ускоряя химические реакции без участия в самих реакциях. Оксиды переходных металлов могут также образовывать соединения с другими веществами, например, с кислородом, образуя окислы, или с кислотами, образуя соли.
Какие переходные металлы образуют оксиды?
Оксиды образуются из многих переходных металлов, включая железо, медь, никель, цинк, кобальт, хром, марганец, ванадий и другие. Каждый из этих металлов может образовывать несколько различных оксидов, в зависимости от степени окисления металла. Например, железо образует оксиды FeO, Fe2O3 и Fe3O4, а медь образует оксиды CuO и Cu2O.
