Оксиды металлов являются важными соединениями, которые образуются в результате взаимодействия металлов с кислородом. Вода является одним из наиболее распространенных оксидов металлов и состоит из водорода и кислорода. Однако также существует ряд других оксидов металлов, которые могут быть восстановлены водородом.
Один из примеров таких оксидов металлов - оксид железа (Fe2O3), он является основным компонентом естественных минералов, таких как гематит. Восстановление оксида железа водородом приводит к образованию металлического железа и воды. Этот процесс, известный как гидрогенизация, является важным способом получения металлов из их оксидов.
Другим примером оксидов металлов, которые могут быть восстановлены водородом, является оксид меди (CuO). Восстановление оксида меди водородом ведет к образованию металлической меди и воды. Этот процесс широко используется в промышленности для получения меди. Кроме того, оксид меди также используется в качестве катализатора в реакциях окисления-восстановления.
Восстановление оксидов металлов водородом имеет широкий спектр применений, начиная от промышленности до научных исследований. Этот процесс является не только экономически эффективным, но и экологически безопасным, поскольку не требует использования опасных химических веществ. Благодаря своим уникальным свойствам, водород является полезным редукционным агентом для восстановления оксидов металлов и открывает новые перспективы в области зеленой химии и экологически устойчивого развития.
Оксиды металлов:

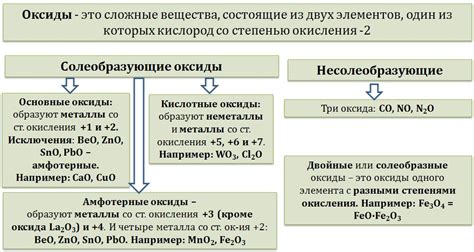
Оксиды металлов – важный класс неорганических соединений, состоящих из металлов и кислорода. Эти соединения широко распространены в природе и имеют большое значение как сырье для производства различных материалов и химических веществ.
Оксид металла образуется при соединении металла с кислородом. Они могут иметь различную степень окисления металла и разное строение, что влияет на их физические и химические свойства. В зависимости от состава и свойств оксиды металлов могут быть кислотными, щелочными или амфотерными.
Кислотные оксиды образуют кислотные растворы, реагируют с основаниями, образуя соли и воду. Примерами кислотных оксидов являются оксид серы (SO2), оксид азота (NO2) и оксид углерода (CO2).
Щелочные оксиды реагируют с водой, образуя щелочи. Они обладают щелочной реакцией и растворяются в воде, образуя гидроксиды металлов. Примером щелочного оксида является оксид натрия (Na2O).
Амфотерные оксиды могут проявлять как кислотные, так и щелочные свойства в зависимости от условий реакции. Они реагируют как с кислотами, так и с основаниями, образуя соли и воду. Примером амфотерного оксида является оксид алюминия (Al2O3).
- Оксиды металлов используются в производстве керамики, стекла, цемента и других строительных материалов.
- Они находят применение в химической промышленности для синтеза различных веществ.
- Некоторые оксиды металлов используются в качестве катализаторов в химических реакциях.
- Оксиды металлов широко применяются в электронике и электротехнике для создания полупроводников и проводников.
Восстановление оксидов металлов водородом является одним из способов получения металлов и их соединений. При этом водород служит восстановителем, превращая оксиды в металлы и образуя воду. Этот процесс находит применение в различных отраслях промышленности, например, при производстве цветных металлов и сплавов, а также в процессе получения водорода.
Металлы, которые могут быть восстановлены водородом

В химии существует немало металлов, которые могут быть восстановлены с помощью водорода. Восстановление – это процесс, при котором окислитель принимает электроны от восстанавливающегося вещества. В данном случае, водород действует как восстанавливающий агент, а металлы – как окислители.
Один из таких металлов – магний. Восстановление магния водородом происходит по реакции: Mg + H2 → MgH2. Магний является легким и прочным металлом, который обладает способностью вступать в реакцию с водородом при нагревании. Образующийся результатом этой реакции гидрид магния (MgH2) широко используется в различных отраслях промышленности, например, в качестве сырья для производства катализаторов и хранения водорода.
Другим примером металла, восстановление которого возможно с помощью водорода, является железо. Восстановление железа водородом происходит по реакции: Fe2O3 + 3H2 → 2Fe + 3H2O. Железо образует различные оксиды, в том числе трехвалентный (Fe2O3), который может быть восстановлен в металлическое железо при воздействии водорода. Это является одним из методов получения чистого железа в промышленности.
Также к металлам, которые могут быть восстановлены водородом, относятся алюминий (Al), никель (Ni), цинк (Zn), свинец (Pb) и многие другие. Реакции восстановления данных металлов осуществляются в различных условиях в соответствии с их химическими свойствами и требованиями производства.
Оксиды металлов:

Оксиды металлов - это химические соединения, состоящие из металлического и кислородного атомов. Они обладают различными свойствами и широко применяются в различных отраслях промышленности и науки.
Оксид железа (Fe2O3), также известный как ржавчина, является одним из наиболее распространенных оксидов металлов. Он обладает красно-коричневым цветом и используется в производстве стали, красок и косметики. Оксид железа также играет важную роль в природной экосистеме, так как является основным компонентом почвы.
Оксид алюминия (Al2O3), известный как глина, обладает высокой термической стабильностью и применяется в производстве керамики, огнеупорных материалов и алюминиевых сплавов. Оксид алюминия также используется в качестве абразивного материала в шлифовальных средствах.
Оксид цинка (ZnO) - белый порошок, широко применяемый в производстве косметических и фармацевтических продуктов. Он также используется в солнечных батареях и как пигмент в красках. Оксид цинка обладает антибактериальными свойствами и часто добавляется в средства для защиты от солнца.
Оксиды металлов являются важными соединениями, которые находят применение в различных областях. Они имеют различные физические и химические свойства, что позволяет использовать их в различных технологиях и промышленных процессах.
Процесс восстановления водородом

Водород является мощным восстановителем и может быть использован для восстановления различных оксидов металлов. Процесс восстановления водородом позволяет превратить оксиды металлов обратно в основной металл, что может быть полезным во многих промышленных процессах.
Процесс восстановления водородом заключается в том, что молекулы водорода (H2) взаимодействуют с атомами кислорода (О) в оксиде металла. В результате этого происходит образование воды (Н2О), а исходный металл восстанавливается. Этот процесс можно представить следующим образом:
- Атомы кислорода в оксиде металла привлекают молекулы водорода.
- Молекулы водорода отдают свои электроны атомам кислорода.
- Атомы кислорода и молекулы водорода соединяются, образуя молекулы воды.
- Металл восстанавливается, а оксид металла превращается в воду.
Процесс восстановления водородом может быть проведен при различных температурах и давлениях в зависимости от конкретного оксида металла. В некоторых случаях требуется также использование катализатора для облегчения реакции.
Применение водорода для восстановления оксидов металлов широко используется в промышленности, включая восстановление оксидов железа в процессе производства стали и восстановление оксида меди в процессе получения чистого металла. Этот процесс также может быть использован для восстановления других оксидов металлов, таких как оксид алюминия или оксид титана, для получения соответствующих металлических элементов.
Оксиды металлов, которые реагируют с водородом
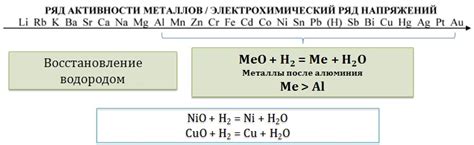
Многие оксиды металлов могут быть восстановлены водородом при определенных условиях. Реакция водорода с оксидами металлов происходит с образованием соответствующих металлов и воды. Такие реакции являются важными процессами в химической промышленности и научных исследованиях.
Некоторые из оксидов металлов, которые реагируют с водородом, включают оксиды легких металлов, таких как литийоксид (Li2O), натрийоксид (Na2O) и калийоксид (K2O). Эти оксиды образуются при взаимодействии металлов со кислородом и могут быть использованы в реакциях с водородом для получения соответствующих металлов.
Одним из примеров является реакция водорода с оксидами железа, такими как оксид железа (III) (Fe2O3) и оксид железа (II) (FeO). В результате таких реакций образуется металлическое железо и вода. Эти реакции широко применяются в металлургии для производства железа и его сплавов.
Также стоит отметить оксиды тяжелых металлов, которые могут быть восстановлены водородом. Например, оксид меди (II) (CuO) и оксид цинка (ZnO) могут быть превращены обратно в металлы при взаимодействии с водородом. Эти реакции используются в различных промышленных процессах, включая получение меди и цинка.
Таким образом, реакция водорода с оксидами металлов представляет собой важный способ получения металлов и находит применение в различных сферах промышленности и науки.
Применение оксидов металлов в водородной энергетике

Водород является одним из наиболее перспективных и экологически чистых источников энергии. Для его производства широко используются различные методы, включая восстановление оксидов металлов водородом.
Оксиды металлов, такие как оксид железа, оксид меди и оксид цинка, могут быть эффективно восстановлены водородом, освобождая при этом молекулярный водород. Это происходит в результате реакции между оксидами металлов и водородом при высоких температурах.
Водород, полученный из оксидов металлов, может быть использован в различных сферах водородной энергетики. Он может быть использован в топливных элементах, где происходит электрохимическое превращение водорода в электрическую энергию, необходимую для питания различных устройств. Также водород может быть использован в процессе водородного сжигания, при котором энергия, выделенная при сгорании водорода, использована для генерации тепла или электричества.
Преимущества использования оксидов металлов в водородной энергетике включают их высокую реакционную способность, стабильность и низкую стоимость. Также процесс восстановления оксидов металлов водородом может быть управляемым и обратимым, что позволяет эффективно использовать и перерабатывать ресурсы.
В целом, использование оксидов металлов в водородной энергетике представляет собой важный шаг в направлении чистой и устойчивой энергетики. Этот подход может быть востребован в будущем благодаря своим экономическим преимуществам и низкому воздействию на окружающую среду.
Выделение водорода из оксидов металлов
Выделение водорода из оксидов металлов является одним из основных методов получения этого газа. Оксиды металлов, такие как оксид алюминия, оксид цинка, оксид магния и многие другие, могут быть подвергнуты восстановлению водородом.
Процесс выделения водорода из оксидов металлов основан на реакции редукции, при которой металл в оксиде переходит в металлическую форму, а вода превращается в водород. Для этой реакции требуется нагревание оксида металла с водородом.
Выделение водорода из оксидов металлов может быть осуществлено как в промышленных условиях, так и в лаборатории. В промышленности применяются специальные реакторы, в которых оксид металла и водород подвергаются термической обработке при определенных температурах и давлениях. В лабораторных условиях процесс можно провести с использованием нагревательной печи или горелки.
Получение водорода путем выделения его из оксидов металлов широко используется в различных отраслях промышленности. Водород является важным сырьем для производства аммиака, металлов, пластиков и других продуктов. Кроме того, выделение водорода из оксидов металлов имеет большое значение в разработке энергетических технологий на основе водорода, таких как водородные топливные элементы и водородные батареи.
В целом, процесс выделения водорода из оксидов металлов является эффективным и перспективным методом получения этого важного газа. Благодаря возможности использования различных оксидов металлов, этот процесс является универсальным и может быть применен в различных отраслях промышленности и научных исследований.
Вопрос-ответ

Какие металлы образуют оксиды, которые могут быть восстановлены водородом?
Между металлами и кислородом образуются соединения, называемые оксидами. Некоторые металлы, такие как железо, алюминий и цинк, образуют оксиды, которые могут быть восстановлены с помощью водорода.
Как происходит восстановление оксидов металлов водородом?
Восстановление оксидов металлов водородом происходит путем реакции между оксидом и водородом. В процессе реакции металл из оксида восстанавливается до своего элементарного состояния, в то время как водород окисляется до воды.
Какие применения имеет восстановление оксидов металлов водородом?
Восстановление оксидов металлов водородом широко используется в промышленности. Например, восстановление оксида железа водородом может применяться для производства железных сплавов, а восстановление оксида алюминия может использоваться для производства алюминия. Кроме того, этот процесс может быть использован для очистки газов или воды от примесей.
Какую роль играет водород в восстановлении оксидов металлов?
Водород играет роль восстановителя в процессе восстановления оксидов металлов. Он способен отдавать электроны металлам, что позволяет металлам вернуться в их ионное или элементарное состояние. Водород в процессе реакции окисляется до воды.
Какая химическая формула имеет оксид железа, который может быть восстановлен водородом?
Оксид железа, который может быть восстановлен водородом, имеет химическую формулу Fe3O4. Этот оксид известен под названием магнетит, и он может быть восстановлен водородом с образованием железа и воды.
