Восстановление оксидов металлов водородом – это одна из важных реакций в химии, которая позволяет получить металлы из их оксидов. Оксиды металлов являются распространенными соединениями, которые образуются в результате реакции металла с кислородом. Данная реакция представляет большой интерес, так как оксиды металлов находят широкое применение в промышленности и технологии.
Восстановление оксидов металлов водородом происходит за счет присоединения водорода к кислороду в соединении. В результате реакции, оксид металла преобразуется в элементарный металл и образуется вода. К примеру, восстановление оксида железа водородом приводит к образованию чистого железа и пара воды. Такая реакция может проходить при определенных условиях, таких как температура и давление.
Восстановление оксидов металлов водородом применяется в различных областях, включая металлургию, производство сплавов, получение чистых металлов и других промышленных процессах. От выбора оксида металла зависят условия проведения реакции: температура, давление и продолжительность процесса. Однако не все оксиды металлов могут быть восстановлены водородом. Например, стабильные оксиды некоторых металлов, таких как золото и платина, не могут быть восстановлены водородом при обычных условиях.
Оксиды металлов и их взаимодействие с водородом
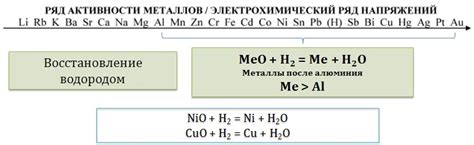
Оксиды металлов - это химические соединения, состоящие из металла и кислорода. Они могут иметь различные степени окисления и разные свойства. Взаимодействие оксидов металлов с водородом основано на процессе восстановления - химической реакции, в результате которой происходит передача электронов.
Восстановление оксидов металлов водородом может происходить в присутствии катализатора, который способствует ускорению реакции. Водород, выступая в качестве восстановителя, передает электроны оксиду металла, при этом оксид металла превращается в металл, а вода образует в результате оксигидрацию водорода.
Восстановление оксидов металлов водородом широко используется в промышленности для получения металлов из их оксидов. Например, восстановление оксида железа Fe2O3 водородом позволяет получить металлическое железо Fe. Аналогичные реакции восстановления применяются и для других металлов, таких как медь, никель, цинк и др.
Для успешного восстановления оксидов металлов водородом важно учитывать условия проведения реакции. Температура, давление, концентрация оксида и т.д. могут влиять на скорость и эффективность процесса. Также необходимо учитывать селективность реакции, то есть способность восстановления только определенных оксидов металлов.
Что такое оксиды металлов и почему они восстанавливаются?

Оксиды металлов представляют собой химические соединения, состоящие из металла и кислорода. Эти соединения широко распространены в природе и обладают различными свойствами и цветами. Оксиды металлов встречаются в виде руд и минералов, таких как гематит, магнетит, оксид железа и других.
Оксиды металлов обычно являются стабильными соединениями, но под действием водорода они могут быть восстановлены до металлической формы. Водород, как сильный восстановитель, способен передавать свои электроны молекулам оксидов металлов, что позволяет изменить степень окисления металла.
Восстановление оксидов металлов водородом является важной реакцией в химических процессах и применяется в различных отраслях промышленности. Например, водородное восстановление используется в производстве металлургических материалов, таких как железо и сталь, а также в каталитических процессах для очистки газов от вредных примесей.
Восстановление оксидов металлов водородом основано на реакции, в ходе которой происходит передача электронов от водорода к металлическому металлу, вызывая изменение его окислительного состояния. Это позволяет эффективно и экономически восстанавливать оксиды металлов и получать чистые металлические соединения для дальнейшего использования.
Примеры оксидов металлов, восстанавливаемых водородом

Восстановление оксидов металлов водородом – это процесс, при котором водород обеспечивает электроны для окислителя, что позволяет превратить оксид металла обратно в металл. Структура и свойства оксидов металлов могут различаться, поэтому не все оксиды металлов могут быть восстановлены водородом.
Примером оксидов металлов, которые могут быть восстановлены водородом, является оксид железа (III). В этом процессе водород взаимодействует с оксидом железа (III), отбирая у него электроны и превращая его в металлическое железо:
- 3 Fe3+O2- + 4 H2 → 3 Fe + 4 H2O
Восстановление оксида железа (III) водородом широко используется в промышленности для получения металлического железа из руды.
Еще одним примером веществ, которые могут быть восстановлены водородом, является оксид меди (II). В этом случае водород взаимодействует с оксидом меди (II), добавляя необходимые электроны и превращая его в металл меди:
- 2 CuO + H2 → 2 Cu + H2O
Восстановление оксида меди (II) водородом используется при получении меди из ее руды и в процессе электролиза для восстановления медионов в медные атомы.
Таким образом, восстановление оксидов металлов водородом может происходить в различных химических реакциях, превращая оксиды обратно в металлы и имея широкое применение в промышленности и научных исследованиях.
Механизм восстановления оксидов металлов водородом

Восстановление оксидов металлов водородом — это процесс, при котором молекулы водорода передают электроны оксиду металла, приводя к его превращению в металл и образованию воды. Этот процесс осуществляется на поверхности оксидного слоя, который является активным центром реакции.
Механизм восстановления оксидов металлов водородом может быть различным и зависит от свойств оксида металла, вида катализатора и условий проведения реакции. Один из возможных механизмов включает адсорбцию водорода на поверхности оксида металла, последующую диссоциацию молекулы водорода на атомы, а затем реакцию этих атомов с оксидом металла, приводящую к образованию воды и металла.
Восстановление оксидов металлов водородом является важным процессом в различных областях, таких как катализ конверсии отходов, водородное производство, а также в производстве электродов для электролиза воды. Вещества, которые подлежат восстановлению оксидами металлов водородом, включают оксиды железа, никеля, алюминия, кобальта и других металлов.
Механизм восстановления оксидов металлов водородом может быть изучен с помощью различных методов, таких как электрохимические измерения, масс-спектрометрия и спектроскопия. Эти методы позволяют определить скорость реакции восстановления, степень восстановления и специфичность катализатора.
Влияние условий на восстановление оксидов металлов водородом
Восстановление оксидов металлов водородом является важным процессом в химии и промышленности. Ключевыми факторами, влияющими на этот процесс, являются температура, давление и концентрация водорода.
Повышение температуры процесса ведет к увеличению скорости восстановления оксидов металлов. Это связано с увеличением количества активных частиц и их кинетической энергии. Высокая температура также способствует улучшению равновесия реакции в пользу образования металла.
Давление водорода также оказывает существенное влияние на восстановление оксидов металлов. Увеличение давления водорода приводит к повышению концентрации водородных ионов, ускоряя реакцию восстановления оксидов металлов. Однако слишком высокое давление может стать негативным фактором, вызывая нежелательные побочные эффекты и ухудшая экономическую эффективность процесса.
Концентрация водорода также играет важную роль в восстановлении оксидов металлов. Повышение концентрации водорода приводит к увеличению скорости реакции, но только до определенного предела. Слишком высокая концентрация водорода может вызывать нежелательные побочные эффекты и ухудшение качества полученных продуктов.
Все эти факторы взаимодействуют между собой и требуют комбинаторного подхода для оптимизации процесса восстановления оксидов металлов водородом. Известное сочетание определенных температуры, давления и концентрации водорода позволяет достичь наилучших результатов и максимальной эффективности этого процесса.
Вопрос-ответ

Какие металлы можно восстановить водородом?
Водород может восстановить различные металлы, такие как железо, медь, цинк, никель, марганец и другие. Восстановление металлов водородом является важной химической реакцией, которая широко используется в промышленности.
Как происходит восстановление оксидов металлов водородом?
Восстановление оксидов металлов водородом осуществляется путем взаимодействия оксида металла с водородом при нагревании. На этапе реакции водород отдает электроны оксиду металла, что приводит к образованию металла и воды.
Какие вещества подлежат восстановлению в ходе реакции с водородом?
Водород может восстановить оксиды металлов, такие как оксид железа (Fe2O3), оксид меди (CuO), оксид цинка (ZnO), оксид никеля (NiO), оксид марганца (MnO2) и многие другие. Восстановление оксидов металлов водородом является эффективным способом получения чистых металлов.
Какие примеси могут присутствовать в оксидах металлов и мешать их восстановлению водородом?
Оксиды металлов могут содержать различные примеси, такие как другие оксиды, соли и органические соединения. Некоторые из этих примесей могут мешать процессу восстановления водородом, поскольку они могут быть менее реактивными или образовывать стабильные соединения с водородом.
Что происходит с оксидами металлов после восстановления водородом?
После восстановления водородом оксиды металлов превращаются в соответствующие металлы, а вода образовавшаяся в результате реакции испаряется или удаляется. Восстановленные металлы могут быть использованы для различных целей, включая производство металлических изделий и материалов.
