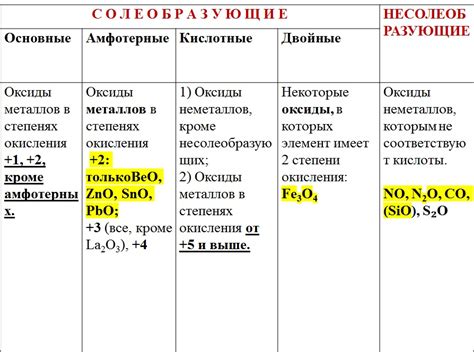
Оксиды металлов – это химические соединения, состоящие из металлического элемента и кислорода. Они являются одними из основных классов соединений, которые образуются при окислении металлов. Свойства растворимости оксидов металлов определяют их способность диссоциировать в водных растворах и взаимодействовать с другими веществами.
Растворимость оксидов металлов зависит от различных факторов, таких как ионный радиус металла, электроотрицательность металла и pH раствора. Некоторые оксиды металлов, такие как оксиды алкалийных и щелочноземельных металлов, хорошо растворяются в воде и образуют щелочные растворы. Они обладают высокой проводимостью электрического тока и обычно проявляют щелочные свойства.
В то время как некоторые оксиды металлов растворяются в воде, другие могут быть нерастворимыми или плохо растворимыми. Например, оксиды переходных металлов, такие как оксид железа (III), образуют нерастворимые осадки или гели в водных растворах. Такие оксиды металлов могут обладать кислотными или амфотерными свойствами, взаимодействуя с кислотами или щелочами.
Изучение свойств растворимости оксидов металлов имеет важное значение для понимания их физико-химических свойств и применения в различных промышленных и научных областях. Познание растворимости оксидов металлов позволяет разрабатывать новые материалы, катализаторы и электрохимические системы, а также улучшать процессы производства и обработки металлов.
Свойства оксидов металлов
Оксиды металлов – это химические соединения, состоящие из металла и кислорода. Они обладают рядом особенных свойств, которые делают их интересными объектами исследования.
Растворимость
Свойства растворимости оксидов металлов могут быть различными. Некоторые оксиды металлов легко растворяются в воде, образуя гидроксиды, другие плохо растворяются или вообще нерастворимы. Например, оксиды щелочных металлов, таких как натрий или калий, образуют очень щелочные растворы, а оксиды металлов пятой группы периодической системы (например, оксид антимония) образуют кислотные растворы.
Ионизация
Оксиды металлов обычно ионизируются при растворении в воде. Это означает, что они распадаются на ионы металла и кислорода. Ионы металла могут образовывать соли с различными анионами, что позволяет оксидам металлов участвовать во многих химических реакциях.
Топлительные свойства
Некоторые оксиды металлов обладают топлительными свойствами, то есть могут гореть в присутствии кислорода, выделяя при этом тепло и свет. Примером такого оксида является оксид магния, который применяется для получения яркого света в магниевых фотовспышках.
Оксидационные свойства
Оксиды металлов могут принимать участие в окислительно-восстановительных реакциях. Они способны окислять другие вещества, отдавая свои кислородные атомы, и сами восстанавливаться. Это свойство имеет важное применение в многих технологических процессах и производствах.
Таким образом, оксиды металлов обладают разнообразными и интересными свойствами, которые делают их важными объектами изучения в химической науке. Их свойства растворимости, ионизации, топлительные и окислительно-восстановительные свойства определяют их физические и химические свойства и разнообразное применение в различных отраслях промышленности и научных исследованиях.
Растворимость оксидов металлов в воде
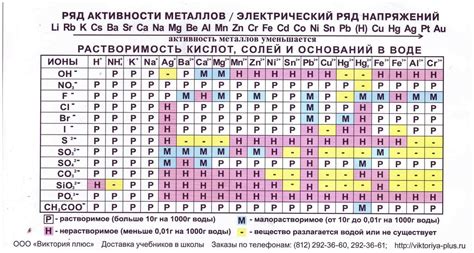
Оксиды металлов являются химическими соединениями, состоящими из атомов металла и атомов кислорода. Они обладают различным уровнем растворимости в воде, что определяется их химической структурой и электрохимическими свойствами.
Некоторые оксиды металлов легко растворяются в воде и образуют растворы, которые могут быть как кислотными, так и щелочными. Такие оксиды называются гидроксидами металлов. Они обладают свойством образовывать ионы металла и гидроксид-ионы в растворе.
Однако большинство оксидов металлов плохо растворяются в воде. Это связано с тем, что они образуют стабильные сетчатые структуры, в которых атомы металла и кислорода тесно связаны друг с другом. Такие оксиды называются нерастворимыми в воде.
Растворимость оксидов металлов в воде может быть изменена при изменении pH раствора. Например, некоторые оксиды металлов, которые являются нерастворимыми в нейтральной воде, могут растворяться при добавлении к ней кислоты или щелочи. Это связано с изменением ионизации молекул оксида под воздействием изменения pH раствора.
Таким образом, растворимость оксидов металлов в воде зависит от их химической структуры, электрохимических свойств и pH раствора. Изучение растворимости оксидов металлов помогает понять их химические свойства и использовать их в различных процессах и применениях, таких как производство керамики, стекла, катализаторов и других материалов.
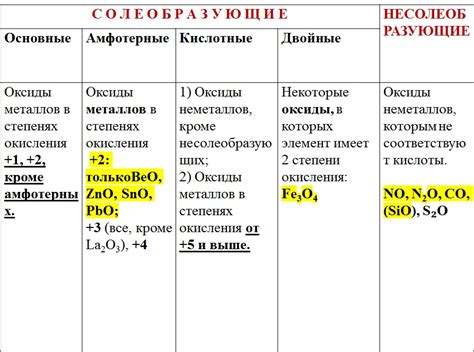
Факторы, влияющие на растворимость оксидов металлов

Растворимость оксидов металлов зависит от нескольких факторов, которые оказывают влияние на их химические и физические свойства. Одним из главных факторов является степень окисления металла в оксиде. Чем выше степень окисления, тем более растворим будет оксид металла. Это связано с увеличением электроотрицательности металла и, следовательно, его способности образовывать ионы в растворе.
Еще одним фактором, влияющим на растворимость оксидов металлов, является растворитель, в котором проводится процесс растворения. Оксиды металлов могут быть растворимыми в различных растворителях в зависимости от их полярности и взаимодействия с ионами металла. Например, оксиды легкоплавких металлов, таких как щелочные и щелочноземельные металлы, обычно легко растворимы в воде.
Также на растворимость оксидов металлов может влиять pH раствора. Некоторые оксиды металлов, такие как оксид алюминия, образуют ионы в щелочной среде, но становятся малорастворимыми в кислой среде. Это связано с изменением ионизации оксида в зависимости от кислотно-щелочного баланса.
Наконец, температура также может оказывать влияние на растворимость оксидов металлов. Обычно повышение температуры увеличивает скорость растворения оксидов, так как увеличивается энергия молекул и их подвижность. Однако есть исключения, например, некоторые оксиды металлов могут становиться менее растворимыми при повышении температуры из-за обратимых физических реакций.
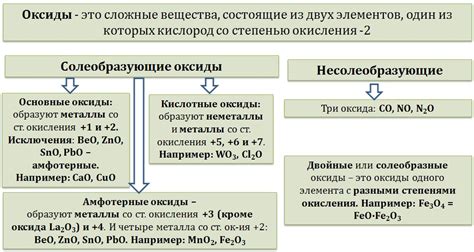
Примеры растворимых и нерастворимых оксидов металлов
Оксиды металлов - химические соединения металла с кислородом, которые могут быть как растворимыми, так и нерастворимыми в воде.
Примеры растворимых оксидов металлов:
- Оксид натрия (Na2O) - это белый кристаллический порошок, хорошо растворимый в воде. Он является основным оксидом и образуется при реакции натрия с кислородом.
- Оксид калия (K2O) - это белый порошок, также легко растворимый в воде. Он образуется при окислении калия воздухом.
- Оксид кальция (CaO) - также известный как известь или гашеная известь. Он широко используется в строительстве и также хорошо растворим в воде.
Примеры нерастворимых оксидов металлов:
- Оксид алюминия (Al2O3) - это белый порошок, который плохо растворим в воде. Он используется в производстве керамики и алюминиевого сплава.
- Оксид железа (Fe2O3) - известный как ржавчина, не растворяется в воде. Он имеет красно-коричневый цвет и широко используется в производстве красок и пигментов.
- Оксид свинца (PbO) - также известный как "белый свинец", является нерастворимым в воде оксидом металла. Он использовался в прошлом в производстве керамики и стекла.
Таким образом, растворимость оксидов металлов в воде зависит от их химических свойств и структуры.
Применение растворимых и нерастворимых оксидов металлов
Оксиды металлов имеют широкое применение в различных отраслях промышленности и научных исследованиях. В зависимости от своей растворимости, оксиды металлов могут использоваться как катализаторы, в процессе производства стекла, керамики, электрохимических элементов и других продуктов.
Растворимые оксиды металлов обладают способностью растворяться в воде или других растворителях, образуя ионные растворы. Это свойство делает их полезными для использования в процессе химических реакций, в том числе в качестве катализаторов. Например, в промышленности растворимые оксиды металлов используются для улучшения скорости реакций, повышения выборки продукции, а также для контроля степени окисления в химических процессах.
С другой стороны, нерастворимые оксиды металлов имеют ограниченное применение из-за своей нерастворимости в воде и других растворителях. Однако они могут быть использованы в качестве пигментов, добавок к керамике и стеклу, а также в процессе синтеза новых материалов. Нерастворимые оксиды металлов также используются в качестве катализаторов при химических реакциях, которые требуют высоких температур и давления.
Растворимость оксидов металлов зависит от их химической структуры, свойств и условий окружающей среды. Использование растворимых и нерастворимых оксидов металлов позволяет создавать разнообразные продукты с уникальными свойствами, а также обеспечивает развитие научных исследований и технологический прогресс в различных областях.
Вопрос-ответ

Какие металлы образуют растворимые оксиды?
Растворимые оксиды образуют большинство щелочных металлов (например, натрий, калий) и щелочноземельных металлов (например, магний, кальций).
Почему оксиды некоторых металлов растворимы в воде, а оксиды других металлов - нет?
Растворимость оксидов зависит от их химической природы. Некоторые оксиды обладают основными свойствами и растворяются в кислой среде, а другие оксиды являются кислотными и растворяются в щелочной среде.
Какие факторы влияют на растворимость оксидов металлов?
Растворимость оксидов зависит от температуры, давления и свойств веществ, в которых происходит растворение. Например, повышение температуры обычно способствует увеличению растворимости оксидов.
Какие свойства имеют растворимые оксиды металлов?
Растворимые оксиды металлов обычно обладают щелочными свойствами, то есть способны реагировать с кислотами и образовывать соли. Кроме того, они часто образуют растворы с щелочной реакцией.
Как оксиды влияют на растворимость металлов в воде?
Оксиды металлов могут влиять на растворимость других металлов в воде. Например, некоторые оксиды могут образовывать комплексные соединения с металлами, что может повысить их растворимость или, наоборот, уменьшить.
