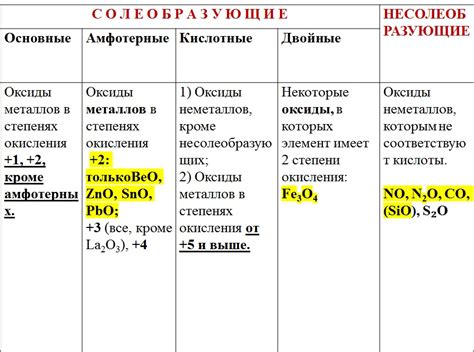
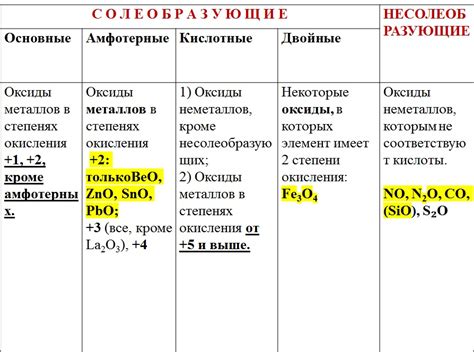
Оксиды металлов – это химические соединения, состоящие из металла и кислорода. В чистом виде они обычно представляют собой твердые вещества, химически инертные и плохо растворимые в воде. Однако оксиды металлов играют важную роль в различных областях, таких как промышленность, медицина и наука.
В зависимости от соотношения металла к кислороду в составе оксида, они могут образовывать различные типы соединений. Например, оксиды, в которых металл находится только в одной степени окисления, называются "основными". Они обычно обладают высокой ионной проводимостью и служат важными электролитами для аккумуляторов и топливных элементов.
Другой тип оксидов – это "кислые" оксиды, в которых металл находится в нескольких степенях окисления. Они обладают кислотными свойствами, что позволяет им использоваться в качестве катализаторов и сорбентов в химических процессах. Некоторые кислые оксиды, такие как диоксид серы или оксид азота, являются сильными окислителями и применяются в производстве удобрений, взрывчатых веществ и других химических соединений.
Структура оксидов металлов
Оксиды металлов представляют собой химические соединения, состоящие из металлического катиона и кислородного аниона. Структура оксидов металлов может быть различной и зависит от химического состава и свойств металла.
Некоторые оксиды металлов имеют ионную структуру, при которой металлический катион образует кристаллическую решетку, а кислородные анионы находятся между ними. Такие оксиды обычно являются твердыми веществами с высокой температурой плавления и низкой подвижностью ионов. Примерами ионных оксидов металлов являются оксиды натрия, калия, кальция и других щелочных и щелочноземельных металлов.
Другие оксиды металлов имеют ковалентную структуру, при которой атомы металла и кислорода образуют совместно используемые электронные пары. В таких оксидах металлов связи между атомами являются сильными, что делает их твердыми и хрупкими веществами с высокой температурой плавления. Примерами ковалентных оксидов металлов являются оксиды кремния, алюминия и других полуметаллов.
Также существуют оксиды металлов с необычной структурой, такие как водные оксиды. В них металлические ионные катионы связаны с кислородными анионами через молекулы воды. Эти оксиды обычно являются гидратами и образуются в результате реакции металлов с водой или водными растворами.
Таким образом, структура оксидов металлов может быть различной и варьировать от ионной до ковалентной и гидратной в зависимости от свойств металла и условий, при которых происходит их образование.
Катионы металлов и анионы кислорода

Оксиды металлов состоят из катионов металлов и анионов кислорода. Катионы металлов - положительно заряженные частицы, которые образуются из металлических элементов, отдавая один или несколько электронов. Анионы кислорода, наоборот, имеют отрицательный заряд, так как они принимают электроны от металла.
Катионы металлов обычно имеют переменную зарядность, поэтому они указываются с применением римских цифр, которые указывают на величину заряда. Например, Fe2+ и Fe3+ представляют двухвалентное и трехвалентное железо соответственно. Катионы отличаются не только зарядом, но и электронной конфигурацией, что влияет на их химические свойства, реакционную способность и способность образовывать соединения с анионами.
Анионы кислорода, входящие в состав оксидов металлов, обычно имеют заряд -2. Они образуются из атомов кислорода, которые принимают два электрона, чтобы достичь стабильной конфигурации, а именно заполнить свою внешнюю энергетическую оболочку. Они обладают сильным отрицательным зарядом, что делает оксиды металлов стабильными и реакционноспособными соединениями.
Образование кристаллической решетки в оксидах металлов происходит благодаря взаимодействию катионов металлов и анионов кислорода. Катионы металлов окружены анионами кислорода, образуя так называемое октаэдрическое окружение. Это взаимодействие создает прочные связи между частицами и определяет физические и химические свойства оксидов металлов.
Свойства оксидов металлов
Оксиды металлов – это химические соединения, состоящие из металлического элемента и кислорода. Они обладают разнообразными физическими и химическими свойствами. Ниже перечислены некоторые из них:
- Твердость: Оксиды металлов обычно являются твердыми веществами. Они могут иметь различную степень твердости в зависимости от своей структуры и состава.
- Инертность: В целом, оксиды металлов обладают высокой инертностью. Они обычно не реагируют с водой или растворами кислот и щелочей. Однако некоторые оксиды металлов могут проявлять кислотные или основные свойства в зависимости от своей природы.
- Прочность: Оксиды металлов могут обладать высокой механической прочностью. Это позволяет им использоваться в качестве строительных материалов, например, в производстве керамики.
- Цвет: Оксиды металлов могут иметь различные цвета, от ярко-белого до черного. Это зависит от состава и структуры соединения.
- Проводимость: Некоторые оксиды металлов, такие как оксиды меди или железа, обладают электрической проводимостью. Они могут использоваться в производстве электроники и электрохимических устройств.
Оксиды металлов играют важную роль в химической промышленности и в природных процессах. Они могут быть использованы в качестве катализаторов, абразивов, пигментов и других материалов. Свойства оксидов металлов могут быть изменены путем введения некоторых примесей, что делает их еще более полезными и востребованными в различных областях науки и промышленности.
Электропроводность
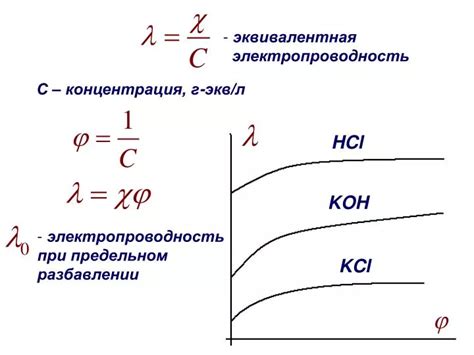
Основной характеристикой оксидов металлов является их электропроводность. Оксиды металлов обладают высокой электропроводностью благодаря тому, что в них содержатся свободные электроны. Эти свободные электроны способны передвигаться в металлической решетке, создавая электрический ток.
Кроме свободных электронов, в оксидах металлов могут присутствовать и ионы металла. Ионы металла также могут способствовать электропроводности оксидов. Как правило, ионы металла имеют положительный заряд и способны находиться в двух различных состояниях: ионизированном и неионизированном.
В ионизированном состоянии ионы металла способны передвигаться по кристаллической решетке оксида, обеспечивая электропроводность. В неионизированном состоянии ионы металла остаются неподвижными и не участвуют в передаче электрического тока.
Важно отметить, что электропроводность оксидов металлов может быть изменена при воздействии различных факторов, таких как температура, давление и наличие других веществ.
Физические и химические свойства
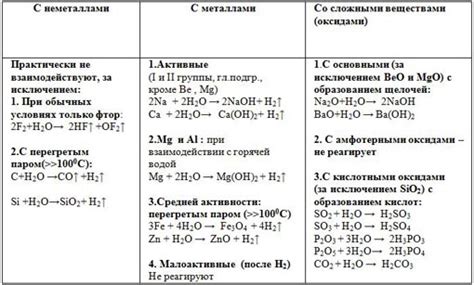
Физические и химические свойства оксидов металлов определяются их составом и структурой. Оксиды металлов обычно представляют собой кристаллические вещества, которые могут быть как ионными, так и ковалентными соединениями. Их кристаллическая структура может быть кубической, гексагональной, тетрагональной и т.д.
Физические свойства оксидов металлов включают плотность, температуру плавления и кипения, теплоемкость и теплопроводность. Например, оксид алюминия (Al2O3), который является одним из наиболее распространенных оксидов, имеет высокую плотность (около 4 г/см3) и высокую температуру плавления (около 2072°С).
Химические свойства оксидов металлов определяют их способность взаимодействовать с другими веществами. Оксиды металлов обладают щелочными, амфотерными или кислыми свойствами. Например, оксид кальция (CaO) обладает щелочными свойствами, так как реагирует с водой, образуя щелочь (гидроксид кальция), а оксид железа(III) (Fe2O3) обладает кислыми свойствами, так как реагирует с щелочами, образуя соответствующие соли.
В зависимости от оксида металла, взаимодействующего с воздухом, можно наблюдать окисление или восстановление. Некоторые оксиды выступают в качестве катализаторов реакций окисления или восстановления. Например, оксид марганца (MnO2) служит катализатором при окислении аммиака до азота, а оксид железа(III) (Fe2O3) используется в катализаторах в процессе аммиакосинтеза.
Виды оксидов металлов
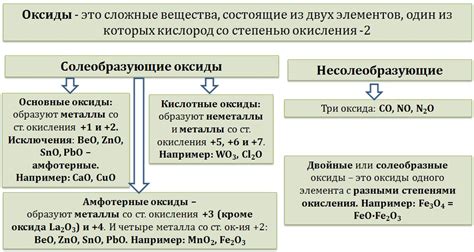
Оксиды металлов представляют собой соединения металла с кислородом. В зависимости от валентности металла и содержания кислорода в соединении, оксиды металлов могут иметь различную структуру и свойства.
Одним из наиболее распространенных типов оксидов металлов являются двуокиси. Они состоят из одного атома металла и двух атомов кислорода. Примерами двуокисей являются оксид железа (Fe2O3) и оксид алюминия (Al2O3).
Некоторые металлы способны образовывать не только двуокиси, но и более высокие оксиды. Например, медь может образовывать двуокись (CuO) и пероксид меди (CuO2). Такие оксиды называются пероксидами и содержат в своей структуре дополнительные атомы кислорода.
Также существуют оксиды с переменной валентностью, которые имеют различное количество кислорода в своей структуре. Например, марганец может образовывать марганцовый оксид (MnO), марганцовистый оксид (MnO2) и марганцевокислый оксид (Mn2O7). Они имеют различные свойства и применяются в разных областях техники и химии.
Некоторые оксиды металлов способны образовывать соли с кислородными кислотами. Например, оксид образует щавелевую кислотную соль (Na2C2O4), а оксид азота образует азотную кислотную соль (NaNO3) и другие.
Вопрос-ответ

Что такое оксиды металлов?
Оксиды металлов - это химические соединения, состоящие из металла и кислорода. Они образуются, когда металл соединяется с кислородом в результате окисления.
Какие основные свойства оксидов металлов?
Оксиды металлов обладают рядом основных свойств. Они обычно являются твердыми веществами, но некоторые могут быть газообразными или жидкими при определенных условиях. Они обычно нерастворимы в воде и образуют щелочные растворы, при взаимодействии с кислотами они образуют соль и воду.
Могут ли оксиды металлов обладать различными цветами?
Да, оксиды металлов могут обладать различными цветами. Например, оксид меди (II) обладает черным цветом, оксид железа (III) имеет красно-коричневый цвет, оксид свинца (II) - желтый и так далее. Цвет оксидов металлов зависит от их структуры и химического состава.
Какие основные методы получения оксидов металлов?
Оксиды металлов могут быть получены различными методами. Одним из главных способов является термическое разложение металла или соединения металла. Например, оксид железа (III) можно получить путем нагревания гидроксида железа (III). Также оксиды металлов могут быть получены путем взаимодействия металла с кислородом или окислителем.
Зачем нам нужны оксиды металлов?
Оксиды металлов имеют широкий спектр применений. Они используются в производстве стекла, керамики, электроники, катализаторов и других материалов. Оксиды металлов также используются в медицине и в различных химических реакциях. Кроме того, некоторые оксиды металлов имеют важное значение в сельском хозяйстве, например, оксиды цинка, железа и меди используются в качестве микроэлементов для растений.
