Оксиды - это соединения металлов или неметаллов с кислородом. Они являются одной из наиболее известных и распространенных классов химических соединений. Оксиды обладают уникальными свойствами и широким спектром применений в различных областях науки и промышленности.
Свойства оксидов металлов и неметаллов существенно различаются. Оксиды металлов, как правило, обладают высокой теплопроводностью, электропроводностью и имеют металлический блеск. Они также обладают способностью образовывать ионы металла и отдают кислородные ионы, что делает их щелочными оксидами. Одним из наиболее известных металлических оксидов является оксид железа, который широко используется в производстве стали и магнитов.
Неметаллические оксиды, напротив, обычно являются хрупкими и непроводящими электричество веществами. Они растворяются в воде, образуя кислоты, что делает их кислотными оксидами. Одним из наиболее известных неметаллических оксидов является диоксид углерода, или углекислый газ, который играет важную роль в атмосфере и жизни на Земле.
Применение оксидов металлов и неметаллов весьма широко. Металлические оксиды используются в металлургии, электронике, керамике и стеклопроизводстве, а также в производстве катализаторов и красителей. Неметаллические оксиды находят применение в производстве химических веществ, лекарственных препаратов, пластиков и других материалов. Кроме того, оксиды играют важную роль в процессах окисления и восстановления в химических реакциях.
Металлические оксиды

Металлические оксиды - это соединения металлов с кислородом, которые образуются при окислении металлов. Они имеют разнообразные свойства и широко применяются в различных областях науки и техники.
Одним из основных свойств металлических оксидов является их высокая термическая стабильность. Они обладают высокой температурой плавления и жаростойкостью, поэтому могут использоваться в процессах высокотемпературной обработки материалов.
Металлические оксиды также обладают хорошей проводимостью электричества и тепла. Это их особенность делает их незаменимыми материалами в электронике и термоэлектрике. Оксиды различных металлов используются для создания полупроводниковых элементов, датчиков, катализаторов и других устройств.
Металлические оксиды также широко применяются в качестве красителей и пигментов. Они обладают яркими и стойкими цветами, поэтому используются в производстве красок, керамики, стекла и даже в косметике.
Кроме того, некоторые металлические оксиды обладают фоточувствительностью, то есть способностью изменять свои физические свойства под воздействием света. Это свойство используют в солнечных батареях и других устройствах солнечной энергетики.
В целом, металлические оксиды являются важными компонентами в различных областях науки и техники благодаря своим уникальным свойствам и разнообразным применениям.
Свойства металлических оксидов
Металлические оксиды - это соединения, образованные при соединении металла с кислородом. Они обладают рядом характерных свойств, которые делают их важными в различных отраслях промышленности и науки.
Одним из основных свойств металлических оксидов является их высокая проводимость электричества и тепла. Именно благодаря этому свойству они находят широкое применение в электронике, производстве проводников и теплообменников.
Еще одним важным свойством металлических оксидов является их химическая активность. Они обладают способностью взаимодействовать с различными веществами и претерпевать химические реакции. Это делает их важными компонентами для получения различных соединений и материалов.
Металлические оксиды также обладают высокой термической стабильностью. Они обычно выдерживают высокие температуры без разрушения или изменения своих свойств. Именно благодаря этому свойству они используются в высокотемпературных процессах и материалах, таких как обманки и катализаторы.
Кроме того, металлические оксиды обычно обладают хорошей стабильностью в водных растворах. Они не растворяются в воде и не претерпевают химические изменения при взаимодействии с водными растворами. Это делает их полезными в процессах очистки воды и в производстве керамики и стекла.
Применение металлических оксидов

Металлические оксиды имеют широкий спектр применения в различных областях науки и промышленности. Они обладают уникальными свойствами, которые позволяют использовать их для решения разных задач.
Одно из основных применений металлических оксидов - это в качестве катализаторов. Они используются в процессах химической промышленности для ускорения реакций и повышения их эффективности. Катализаторы на основе металлических оксидов обладают специфической активностью и селективностью, что позволяет получать нужные продукты с высокой степенью чистоты.
Другое важное применение металлических оксидов - их использование в электронных устройствах. Некоторые металлические оксиды обладают полупроводниковыми свойствами и могут использоваться в полупроводниковых чипах и транзисторах. Они способны проводить электрический ток при определенных условиях и обладают высокой стабильностью и долговечностью.
Металлические оксиды также широко используются в производстве керамики и стекла. Они придают материалам нужные свойства, такие как прочность, тепло- и шумоизоляция, устойчивость к температурным изменениям. Например, оксид алюминия используется для производства высокотемпературных керамических изделий, которые применяются в авиационной и космической промышленности.
Металлические оксиды также применяются в области солнечной энергетики. Они могут использоваться в качестве фотокатодов и фотогальванических элементов, преобразующих солнечную энергию в электрическую. Благодаря своим свойствам, металлические оксиды способны эффективно улавливать и преобразовывать солнечное излучение, что делает их перспективным материалом для создания энергонезависимых систем.
Неметаллические оксиды

Неметаллические оксиды – это соединения, образованные кислородом и неметаллами. Они обладают рядом свойств и применений, которые делают их важными в различных отраслях науки и промышленности.
Одним из наиболее известных неметаллических оксидов является углекислый газ (СО₂), который является продуктом сгорания угля, газа и других углеводородных веществ. Он широко используется в процессе пищевого производства, при воздушной сепарации, а также в производстве газоанализаторов и карбонаторов.
Другим примером является оксид азота (NOₓ), который образуется в результате сжигания топлива в двигателях внутреннего сгорания. Он играет важную роль в атмосферной химии и является основным компонентом смога. Кроме того, оксид азота используется в медицине и фармацевтике для лечения и противовоспалительных целей.
Еще одним примером неметаллического оксида является оксид серы (SO₂), который образуется при сжигании топлива. Он является одним из главных причин образования кислотных дождей и проблем с окружающей средой. Однако оксид серы также используется в производстве серной кислоты и сульфитов, а также в других процессах промышленности.
Немеласный оксид (N₂O), также известный как "зубная газ", является еще одним неметаллическим оксидом. Он широко применяется в стоматологии для обезболивания и снижения тревожности пациента. Кроме того, оксид азота используется в пищевой промышленности для аэрации продуктов и увеличения срока их годности.
Свойства неметаллических оксидов

Неметаллические оксиды представляют собой соединения, в которых атомы неметалла связаны с атомом кислорода. Такие оксиды обладают рядом свойств, которые определяют их особенности и применение в различных областях науки и техники.
1. Химический характер: неметаллические оксиды проявляют кислотные свойства и способны образовывать кислоты при взаимодействии с водой. Это связано с тем, что при взаимодействии оксидов с водой образуется кислородная кислота.
2. Физические свойства: неметаллические оксиды чаще всего представлены в виде газов или твердых веществ с высокой температурой плавления и кипения. Некоторые неметаллические оксиды обладают высокой теплопроводностью и электропроводностью.
3. Растворимость: неметаллические оксиды обычно плохо растворяются в воде, но могут быть растворимы в других растворителях, таких как алкоголь или кислоты. Растворимость неметаллических оксидов зависит от их структуры и связей в молекулах.
4. Агрегатные состояния: некоторые неметаллические оксиды могут существовать в различных агрегатных состояниях, таких как газ, жидкость или твердое вещество. Это зависит от условий температуры и давления.
5. Применение: неметаллические оксиды широко используются в различных областях промышленности, в том числе в производстве стекла, керамики, электроники и катализаторов. Они также применяются в качестве соединений для получения разных видов кислот и солей.
Применение неметаллических оксидов

Оксид углерода (CO2) – один из самых распространенных неметаллических оксидов, активно применяемый в различных отраслях. В промышленности он используется в качестве сырья для производства соды, углекислого газа, метанола и других химических веществ.
Еще одним примером неметаллического оксида является оксид серы (SO2). В промышленности он широко применяется в качестве дезинфицирующего средства, консерванта и отбеливающего агента. Кроме того, оксид серы используется в производстве серной кислоты, спиртного уксусного брожения, целлюлозы и других продуктов.
Еще одним примером неметаллического оксида является оксид азота (NO2). Он применяется в автомобильной промышленности для производства катализаторов и улучшения качества выхлопных газов. Оксид азота также используется в медицине для расширения сосудов и лечения некоторых заболеваний.
Также стоит отметить оксид фосфора (P2O5), который применяется в качестве катализатора и сырья для производства фосфорной кислоты, удобрений и других химических соединений.
Применение неметаллических оксидов в различных отраслях свидетельствует о их значимости и широком спектре возможностей. Они являются неотъемлемой частью многих процессов и сырьевых цепочек, играют важную роль в индустрии и научных исследованиях.
Реакции оксидов с водой и кислотами

Оксиды - это химические соединения, которые образуются при соединении кислорода с другими элементами. Известно множество оксидов металлов и неметаллов, и многие из них проявляют активность при взаимодействии с водой и кислотами.
Взаимодействие оксидов с водой может протекать по разным механизмам. Например, некоторые оксиды металлов, такие как оксид натрия, растворяются в воде, образуя щелочные растворы. Другие оксиды, например, оксид меди, не растворяются в воде, но реагируют с ней, образуя кислотный раствор и выделяя газ.
Взаимодействие оксидов с кислотами также имеет свои особенности. Некоторые оксиды металлов могут реагировать с кислотами, образуя соль и воду. Например, оксид кальция реагирует с соляной кислотой, образуя хлорид кальция и воду.
Оксиды часто используются в промышленности и повседневной жизни. Они широко используются в производстве стекла, керамики, красителей и других материалов. Оксиды также используются в качестве катализаторов в различных химических процессах.
В заключение, реакции оксидов с водой и кислотами являются важным аспектом химии. Изучение этих реакций позволяет нам понять свойства оксидов и их влияние на окружающую среду.
Вопрос-ответ

Какие свойства имеют оксиды металлов и неметаллов?
Оксиды металлов и неметаллов обладают различными свойствами. Оксиды металлов, как правило, являются щелочными или амфотерными соединениями, которые растворяются в воде с образованием оснований. Они имеют высокую температуру плавления, обычно являются твердыми веществами и обладают выраженной электропроводностью. Оксиды неметаллов, напротив, чаще являются кислотными или неокисными соединениями, которые не растворяются в воде. Они также обычно твердые и могут быть электропроводными только в виде расплавов или растворов.
Какие применения есть у оксидов металлов и неметаллов?
Оксиды металлов и неметаллов находят широкое применение в различных областях. Некоторые из них используются в качестве катализаторов в химической промышленности. Например, оксид железа применяется в синтезе аммиака, оксид ванадия используется в производстве кислородных катализаторов. Оксиды кремния и алюминия применяются в промышленности стекла и керамики. Кроме того, некоторые оксиды, такие как оксид меди, используются в производстве красок и красителей, а оксиды цинка и титана - в косметической промышленности.
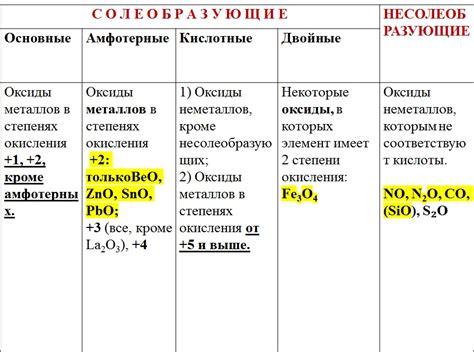
Какие оксиды металлов являются кислотными?
Некоторые оксиды металлов обладают кислотными свойствами. Например, оксид серы и оксид азота являются кислотными оксидами. Они могут реагировать с водой, образуя кислоты. Оксиды железа и алюминия также могут реагировать с водой и образовывать кислоты. Однако большинство оксидов металлов являются основными или амфотерными соединениями, которые реагируют с водой, образуя основания.
