Оксиды являются одними из наиболее распространенных соединений в химии. Они образуются при реакции металлов или неметаллов с кислородом. Но что отличает оксиды металлов от оксидов неметаллов?
Во-первых, химический состав оксидов металлов и неметаллов различен. Оксиды металлов представляют собой соединения содержащие металл и кислород. Наиболее распространенные оксиды металлов включают оксиды железа, алюминия и кальция. Оксиды неметаллов, напротив, содержат неметалл и кислород. К ним относятся, например, оксиды углерода и серы.
Во-вторых, свойства оксидов металлов и оксидов неметаллов также различаются. Оксиды металлов обычно обладают щелочными свойствами, то есть они растворяются в воде и образуют основания. Свойства оксидов неметаллов, в свою очередь, могут быть кислотными, щелочными или нейтральными. Например, оксид серы образует кислотные растворы, а оксид углерода может быть кислотным, нейтральным или щелочным, в зависимости от вида соединения.
Кроме того, оксиды металлов и оксиды неметаллов играют разные роли в природе и промышленности. Оксиды металлов, такие как оксид железа Fe2O3, имеют широкое применение в производстве стали и других металлических сплавов. С другой стороны, оксиды неметаллов, например диоксид серы SO2, играют значительную роль в экологии и могут быть вредными для здоровья человека и окружающей среды.
Таким образом, оксиды металлов и оксиды неметаллов имеют ряд существенных отличий, начиная от химического состава и свойств, и заканчивая применением. Понимание этих различий поможет расширить наши знания о химических соединениях и их важности в различных отраслях науки и промышленности.
Оксиды металлов: химический состав и свойства
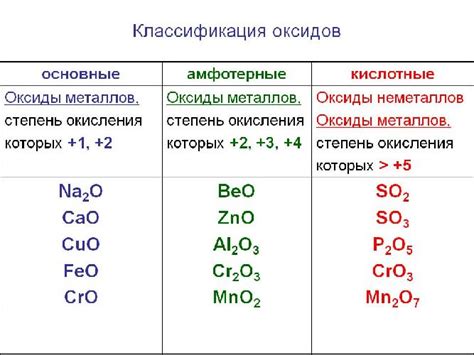
Оксиды металлов - это соединения, состоящие из металлического элемента и кислорода. Химический состав оксидов металлов равен металлу в окисленной форме и молекулярному кислороду. Они образуются в результате реакции окисления металла, в которой атомы металла теряют электроны и образуют положительно заряженные ионы, а кислород принимает электроны и образует отрицательно заряженные ионы.
Оксиды металлов обладают рядом характерных свойств. Они обычно обладают высокой температурой плавления и кипения, что связано с ионными связями в их структуре. Оксиды металлов часто образуют кристаллы с регулярной решеткой и имеют высокую твердость.
- Некоторые оксиды металлов, такие как оксид железа, имеют магнитные свойства и используются в производстве магнитов.
- Оксиды металлов также обладают кислотностью, поэтому они реагируют с щелочами, образуя соли и воду.
- Некоторые оксиды металлов, например оксид алюминия, обладают амфотерными свойствами и могут проявлять и кислотные, и щелочные свойства.
Оксиды металлов широко используются в различных отраслях промышленности. Например, оксид алюминия используется в производстве керамики, стекла и катализаторов. Оксиды металлов также используются в производстве красок, лаков и пигментов благодаря своим окрасочным свойствам.
Состав и структура металлических оксидов

Металлические оксиды - это соединения металлов с кислородом. Они образуются в результате взаимодействия металла с кислородом, например, при нагреве или взаимодействии с кислородом из воздуха. Состав металлических оксидов включает один или несколько металлических элементов и один или несколько атомов кислорода.
Металлические оксиды обладают различной структурой, которая определяется типом и взаимным расположением атомов. Оксиды могут иметь кристаллическую или аморфную структуру. Кристаллические структуры оксидов могут быть простыми или сложными.
Простые кристаллические структуры металлических оксидов включают кубическую, гексагональную, ромбическую и тетрагональную решетки. Сложные кристаллические структуры могут включать слоистые, цепочечные или полимерные структуры.
Свойства металлических оксидов зависят от состава и структуры. Они могут быть проводниками электричества и тепла, иметь высокую температуру плавления и быть химически стабильными. Некоторые металлические оксиды обладают полупроводниковыми свойствами и находят применение в электронике и электротехнике.
Физические и химические свойства оксидов металлов

Физические свойства:
- Оксиды металлов обычно имеют высокую плотность и твердость.
- Многие из них обладают высокой температурой плавления и кипения.
- Они могут быть как прозрачными, так и непрозрачными в зависимости от структуры.
- Многие оксиды металлов обладают хорошей электропроводностью.
Химические свойства:
- Оксиды металлов обычно обладают основными свойствами и способны реагировать с кислотами.
- Взаимодействие с водой может приводить к образованию оснований или кислот в зависимости от свойств металла и условий.
- Некоторые оксиды могут растворяться в кислотах, образуя соли.
- Оксиды металлов могут обладать катализаторными свойствами и использоваться в промышленных процессах, таких как синтез аммиака или производство кислорода.
Изучение физических и химических свойств оксидов металлов позволяет получить более полное представление об их реакционной способности и использовании в различных областях промышленности и науки.
Оксиды неметаллов: особенности химического состава
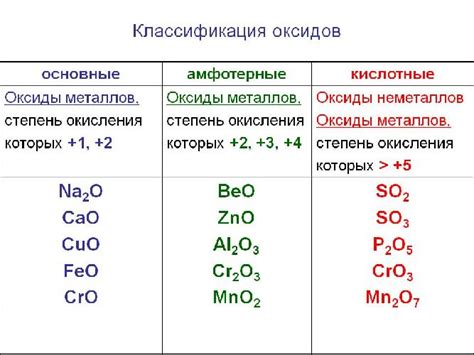
Оксиды неметаллов – это соединения, состоящие из неметаллического элемента и кислорода. Они образуются путем взаимодействия неметаллических элементов с кислородом в химических реакциях. Химический состав оксидов неметаллов может быть разнообразным, в зависимости от комбинирования элементов.
В отличие от оксидов металлов, оксиды неметаллов обычно имеют простой химический состав, состоящий из одного неметаллического элемента и одного атома кислорода. Например, диоксид углерода (СО2), трехокись азота (NO3) и диоксид серы (SO2) – все эти соединения состоят из одного атома неметаллического элемента и двух атомов кислорода.
Одной из особенностей химического состава оксидов неметаллов является их способность образовывать кислоты. Если оксид неметалла растворяется в воде, то образуется кислота. Например, оксид серы (SO2) растворяется в воде и образует сернистую кислоту (H2SO3). Это связано с тем, что вода может взаимодействовать с неметаллическим элементом оксида, образуя кислородные группы с водородом.
Таким образом, оксиды неметаллов имеют особенный химический состав, состоящий из одного неметаллического элемента и кислорода. Наличие кислорода в оксидах неметаллов позволяет им образовывать кислоты. Эти особенности обуславливают свойства и реактивность оксидов неметаллов в химических процессах.
Состав и структура неметаллических оксидов
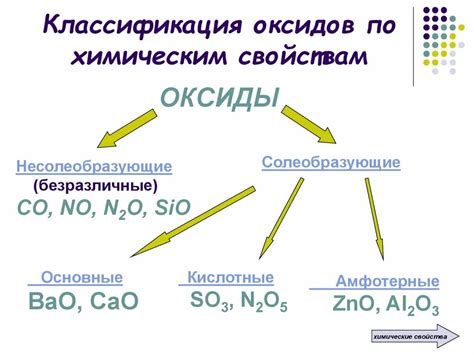
Неметаллические оксиды – это химические соединения, состоящие из неметаллического элемента и кислорода. Они обладают различными структурами, зависящими от свойств и взаимодействия компонентов.
В неметаллических оксидах атомы кислорода связаны с атомами неметалла, образуя структурные единицы. Формирование таких структур происходит путем обмена электронами, образования ковалентных связей или ионных связей.
Основные типы структур неметаллических оксидов включают линейные, планарные и трехмерные структуры. В линейных структурах атомы кислорода и неметалла образуют прямую линию, в планарных – атомы образуют плоскость, а в трехмерных – атомы образуют пространственную структуру.
Стоит отметить, что некоторые неметаллические оксиды могут образовывать полимерные структуры, в которых молекулы соединены в цепочки или сети. Такие структуры обусловливают особые свойства данных соединений.
Состав неметаллических оксидов может быть разнообразным. Одни оксиды состоят только из кислорода и неметалла, другие могут содержать дополнительные элементы. Например, оксид серы (SO2) состоит из серы и кислорода, а оксид азота (NO2) содержит азот, кислород и другие элементы.
Химические свойства и применение оксидов неметаллов

Оксиды неметаллов представляют собой химические соединения, состоящие из неметаллического элемента и кислорода. Они обладают разнообразными химическими свойствами и широко используются в разных областях науки и промышленности.
Одно из важных свойств оксидов неметаллов - их кислотность. Они образуют кислотные растворы при взаимодействии с водой. Например, оксид серы соединяется с водой, образуя сульфидную кислоту. Кроме того, оксиды неметаллов могут реагировать с основаниями, образуя соли.
Некоторые оксиды неметаллов обладают реактивностью и могут быть использованы в качестве окислителей. Например, оксид азота(II) используется в химическом анализе для определения присутствия ионов железа(II) и других примесей. Оксид хлора(VII) является мощным окислителем и используется при получении хлора.
Оксиды неметаллов также находят широкое применение в производстве различных материалов. Например, оксид кремния, или кремнезем, служит основой для производства стекла, керамики и электроники. Оксид алюминия является основным компонентом алюминиевой краски и используется в строительной отрасли для производства строительных материалов.
Некоторые оксиды неметаллов обладают полезными свойствами для медицинского применения. Например, оксид цинка широко используется в солнцезащитных кремах, так как обладает способностью поглощать ультрафиолетовые лучи. Оксид серы применяется в лечении некоторых кожных заболеваний.
Вопрос-ответ

Чем отличаются оксиды металлов и оксиды неметаллов?
Оксиды металлов являются соединениями металлов с кислородом, а оксиды неметаллов - соединениями неметаллов с кислородом или другими элементами.
Какие свойства отличают оксиды металлов от оксидов неметаллов?
Оксиды металлов обычно имеют щелочные свойства, то есть они растворяются в воде, образуя щелочные растворы. Они также могут обладать металлическим блеском и проводимостью электричества. Оксиды неметаллов, напротив, могут иметь кислотные или основные свойства, а также не проводить электричество.
Какие еще различия можно найти между оксидами металлов и оксидами неметаллов?
Оксиды металлов обычно образуют основные растворы, тогда как оксиды неметаллов могут образовывать кислые растворы. Также, многие оксиды металлов являются твердыми веществами при комнатной температуре, в то время как оксиды неметаллов могут быть в газообразном или жидком состоянии.
