Оксиды металлов – это неорганические соединения, состоящие из металла и кислорода. Эти соединения широко распространены в природе и имеют большое значение в различных сферах нашей жизни. Знание оксидов металлов позволяет ученому понять различные процессы, происходящие в природе и промышленности.
Одним из примеров оксидов металлов является оксид железа (III), который состоит из атомов железа и кислорода. Он имеет красноватый цвет и широко используется в производстве различных красителей и пигментов. Оксид железа (III) также является основным компонентом ржавчины, которая возникает при окислении металла в наличии влаги и кислорода.
Еще одним важным оксидом металла является оксид алюминия. Он обладает высокой степенью термической и химической стабильности, поэтому широко используется в производстве керамики, стекла и различных силикатных материалов. Оксид алюминия также является основным компонентом корунда – одного из самых твердых природных минералов.
Знание оксидов металлов позволяет ученикам понять, как эти соединения взаимодействуют с другими веществами и какова роль оксидов в различных процессах, происходящих в природе и на производстве. Изучение оксидов металлов помогает формировать системное представление о строении и свойствах неорганических соединений, а также развивает навыки логического мышления и анализа.
Оксиды металлов: основные свойства и применения
Оксиды металлов являются химическими соединениями, состоящими из металла и кислорода. Они обладают рядом уникальных свойств, которые делают их полезными в различных промышленных и научных областях.
Одним из основных свойств оксидов металлов является их способность взаимодействовать с водой. Многие оксиды металлов реагируют с водой, образуя основания. Эта реакция происходит благодаря наличию кислорода в составе оксидов. Кроме того, оксиды металлов обладают высокой теплостойкостью и устойчивостью к окружающей среде.
Оксиды металлов имеют широкий спектр применений в различных отраслях промышленности. Например, оксид меди, известный как медный оксид, используется в производстве электроники и электротехники. Он обладает высокой электропроводностью и применяется для создания проводников и полупроводников.
Другим примером является оксид алюминия, который широко используется в производстве керамики, стекла и пластмасс. Он обладает высокой твердостью, стойкостью к термическим воздействиям и электрической изоляцией, что делает его идеальным материалом для производства инженерных конструкций и электронных компонентов.
В заключение, оксиды металлов - это важные химические соединения, которые обладают уникальными свойствами и имеют широкий спектр применений. Они являются неотъемлемой частью современной промышленности и науки, и внимание к их изучению и применению помогает нам развиваться и прогрессировать во многих областях жизни.
Оксиды металлов: структура и состав

Оксиды металлов представляют собой соединения металлов с кислородом. Они имеют разнообразные структуры и составы, которые определяют их физические и химические свойства.
Структура оксидов металлов зависит от их состава и способа образования. Некоторые оксиды имеют простую структуру и состоят из одного металлического и нескольких кислородных атомов. Другие оксиды, например, комплексные оксиды, содержат не только металл и кислород, но и дополнительные элементы, такие как антимон, ванадий или хром.
Состав оксидов металлов также может варьироваться. Некоторые оксиды имеют постоянное соотношение между металлическим и кислородным компонентом, например, оксид алюминия (Al2O3) или оксид железа (Fe2O3). Другие оксиды могут содержать переменное соотношение металла и кислорода, что приводит к возможности существования нескольких типов оксидов с разными степенями окисления.
Итак, оксиды металлов представляют собой разнообразные соединения, имеющие различные структуры и составы. Изучение их свойств позволяет лучше понять взаимодействие металлов с кислородом и использовать эти сведения для решения практических задач в области химии и материаловедения.
Физические свойства оксидов металлов

Оксиды металлов представляют собой кристаллические соединения, которые обладают определенными физическими свойствами. В зависимости от их структуры и состава, оксиды металлов могут иметь различные физические свойства.
Одним из важных физических свойств оксидов металлов является их цвет. Многие оксиды металлов обладают яркими цветами, такими как красный, желтый, синий и зеленый. Это связано с наличием определенных примесей в структуре оксидов, которые влияют на поглощение и рассеивание света.
Кроме того, оксиды металлов обычно имеют высокую температуру плавления и кипения. Это связано с высокой энергией связи между атомами в молекуле оксида. Некоторые оксиды металлов, такие как оксид алюминия, обладают высокой твердостью и являются материалами с высокой механической прочностью.
Оксиды металлов также обладают электрическими свойствами. Некоторые оксиды металлов, такие как оксиды меди и железа, обладают полупроводниковыми свойствами и могут использоваться в электронике.
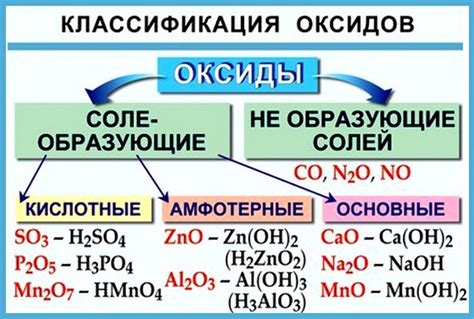
Некоторые оксиды металлов растворяются в воде, образуя щелочные растворы. Такие оксиды называют основными оксидами. Другие оксиды, например оксид серы, образуют кислотные растворы, их называют кислотными оксидами. Также существуют амфотерные оксиды, которые могут растворяться как в кислых, так и в щелочных растворителях.
В целом, физические свойства оксидов металлов зависят от их состава, структуры и условий окружающей среды. Изучение этих свойств помогает лучше понять и применять оксиды металлов в различных областях науки и техники.
Химические свойства оксидов металлов
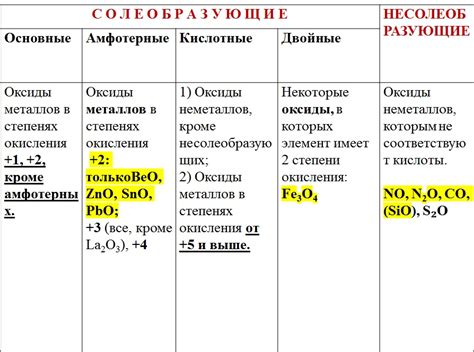
1. Реакция оксидов металлов с водой:
Большинство оксидов металлов при контакте с водой образуют основания. Например, оксиды щелочных металлов, такие как оксид натрия (Na2O) и оксид калия (K2O), реагируют со водой, образуя соответствующие гидроксиды: оксид натрия + вода = гидроксид натрия. В результате происходит реакция гидролиза, при которой вода разлагается.
2. Реакция оксидов металлов с кислотами:
Некоторые оксиды металлов реагируют с кислотами, образуя соли и воду. Например, оксид железа III (Fe2O3) соляной (HCl) = соль железа III (FeCl3) и вода. При этой реакции оксид действует как основание и нейтрализует кислоту.
3. Взаимодействие оксидов металлов с кислородом:
Оксиды металлов могут проявлять окислительные свойства и взаимодействовать с кислородом. Например, оксид алюминия (Al2O3) сорбирует кислород из воздуха и при нагревании меняет свою оксидационную степень. Так же оксид железа II (FeO) может окисляться до оксида железа III (Fe2O3) или восстановляться до металлического железа (Fe).
4. Реакция оксидов металлов с неметаллами:
Оксиды металлов также могут реагировать с неметаллами. Например, оксид кальция (CaO) реагирует с углекислым газом (CO2), образуя углекислый кальций (CaCO3). Такие реакции часто используются в промышленности для получения различных соединений и материалов.
Применение оксидов металлов в различных отраслях промышленности

Оксиды металлов широко применяются в различных отраслях промышленности благодаря своим уникальным свойствам и химической активности. Такие оксиды, как оксид железа (Fe2O3), оксид алюминия (Al2O3) и оксид цинка (ZnO), находят свое применение в металлургии.
Оксиды металлов используются для обработки железных и сталных материалов, предотвращая их коррозию и придавая им дополнительные свойства. Оксиды железа применяются в качестве катализаторов в различных процессах, таких как синтез аммиака и глубинная переработка газа.
Оксиды металлов также широко используются в производстве керамики и строительных материалов. Оксид алюминия, благодаря своей высокой теплостойкости и прочности, применяется для изготовления огнеупорных материалов, керамических изделий и абразивов.
В электронной промышленности оксиды металлов играют важную роль. Оксид индия-олова (ITO) используется для создания прозрачных проводников в сенсорных экранах и жидкокристаллических дисплеях. Оксид кадмия (CdO) применяется для создания полупроводниковых элементов в солнечных батареях.
Другим важным применением оксидов металлов является производство красителей и пигментов. Оксиды железа (Fe2O3 и Fe3O4) используются в производстве красок, косметических средств и пищевых добавок. Оксиды титана, цинка и хрома применяются для получения разнообразных цветовых оттенков в красках и печатных чернилах.
Оксиды металлов имеют широкий спектр применения в различных отраслях промышленности и занимают важное место в создании различных продуктов и материалов, от строительных до электронных.
Вопрос-ответ

