Оксиды металлов являются одной из наиболее распространенных и важных групп химических соединений. Эти соединения состоят из металлического элемента, соединенного с кислородом. В настоящее время известно больше 50 оксидов металлов, каждый из которых обладает уникальными физическими и химическими свойствами.
Оксиды металлов широко распространены в природе и являются основными компонентами многих минералов. Они играют важную роль во многих областях, включая металлургию, электронику, катализ и химическую промышленность. Каждый оксид металла имеет свои уникальные свойства, которые влияют на его применение и прочность связи между металлом и кислородом.
Некоторые оксиды металлов обладают полупроводниковыми свойствами и используются в электронике для создания транзисторов и диодов. Некоторые, например, оксид алюминия, обладают высокой теплоотводящей способностью и используются в производстве радиаторов и теплообменников. Другие оксиды металлов, например, оксид кальция, используются во многих отраслях промышленности, включая строительство, производство стекла и производство стали.
Разнообразие оксидов металлов

Оксиды металлов представляют собой химические соединения, состоящие из металлического элемента и кислорода. В связи с различными свойствами металлов, оксиды металлов также обладают широким спектром химических и физических характеристик.
Природа оксидов металлов может быть разнообразной. Некоторые металлы образуют только один тип оксида, например, железо образует только Fe2O3. В то же время, другие металлы способны образовывать несколько различных оксидов, что зависит от степени окисления металла. Например, медь может образовывать два типа оксидов: Cu2O и CuO.
Свойства оксидов металлов также могут сильно отличаться. Некоторые оксиды обладают прочностью и жесткостью, что делает их идеальным материалом для использования в строительстве и производстве. Другие оксиды обладают полупроводниковыми свойствами, их используют в электронике и солнечных батареях. Есть также оксиды металлов, которые обладают высокой теплопроводностью или магнитными свойствами, и их используют в технологии и промышленности.
Также следует отметить, что оксиды металлов имеют важные приложения в других областях. Например, оксид железа (Fe2O3), известный как красная глина, используется в качестве красителя для окраски стекла, керамики и косметических продуктов. Оксид циркония (ZrO2) используется в стоматологии для создания прочных и долговечных керамических коронок и мостов.
Таким образом, разнообразие оксидов металлов представляет огромный потенциал для применения в различных сферах науки и промышленности, и продолжает оставаться объектом изучения химиков и материаловедов.
Кислород в оксидах металлов
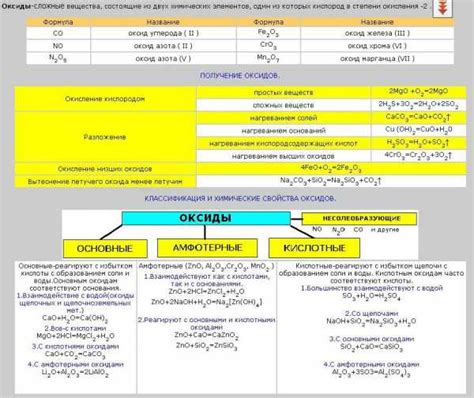
Кислород является одним из химических элементов, который образует оксиды металлов. Оксиды металлов представляют собой химические соединения, состоящие из металла и кислорода.
В оксидах металлов кислород обычно имеет отрицательную степень окисления, что означает, что он принимает электроны от металла. Это связано с тем, что кислород является сильным окислителем.
Оксиды металлов могут иметь различные степени окисления металла и соответственно разные свойства. Некоторые оксиды металлов могут быть кислотными, то есть реагировать с водой и образовывать кислоту. Другие оксиды металлов могут быть основными, то есть реагировать с кислотами и образовывать соль и воду.
Например, оксид железа Fe2O3 является основным и называется оксидом железа(III). Он реагирует с кислотами, образуя соль и воду. Оксид алюминия Al2O3 также является основным и образует соль алюминия и воду при реакции с кислотой.
С другой стороны, оксид углерода CO2 является кислотным и называется углекислым газом. Он реагирует с водой, образуя угольную кислоту H2CO3. Оксид серы SO2 также является кислотным и образует серную кислоту при реакции с водой.
Таким образом, кислород играет важную роль в химии оксидов металлов, влияя на их свойства и способность взаимодействовать с другими веществами.
Физические и химические свойства оксидов металлов

Оксиды металлов - это химические соединения, образованные соединением металла с кислородом. У них есть ряд физических и химических свойств, которые определяют их своеобразие и важность в различных областях.
Физические свойства:
- Оксиды металлов обычно представляют собой твердые вещества, но могут быть и газообразными или жидкими при определенных условиях.
- В зависимости от физических свойств своих составных элементов, оксиды металлов могут иметь различные цвета, от белого до черного и различные степени прозрачности.
- Они обычно обладают высокой плотностью и твердостью, что делает их прочными и устойчивыми к механическим воздействиям.
- Точка плавления и кипения оксидов металлов может сильно варьироваться в зависимости от их химического состава и структуры.
Химические свойства:
- Оксиды металлов являются химически активными соединениями и могут реагировать с другими веществами, образуя новые соединения.
- Они могут быть как основными, так и кислотными в зависимости от своей реакции с водой.
- Оксиды металлов обладают электропроводностью, их используют при создании электродов в электрохимических процессах.
- Некоторые оксиды металлов обладают катализаторными свойствами, способствуя проведению химических реакций.
Изучение физических и химических свойств оксидов металлов позволяет лучше понять их поведение в различных средах и применить их в различных областях, таких как промышленность, медицина и электроника.
Вопрос-ответ

Какие виды оксидов металлов существуют?
Существует большое количество видов оксидов металлов, которые могут образовываться при реакции металлов с кислородом. Некоторые из них включают оксиды алюминия, железа, меди, свинца, цинка, магния и т. д.
Каковы свойства оксидов металлов?
Свойства оксидов металлов могут варьироваться в зависимости от конкретного оксида и металла. Однако, многие оксиды металлов обладают следующими общими свойствами: высокая теплопроводность и теплоемкость, хорошая электропроводность, высокая температура плавления и кипения, а также способность к образованию кислых или щелочных растворов в зависимости от своего химического характера.
