Оксиды металла являются одним из наиболее распространенных классов неорганических соединений, которые образуются при реакции металла с кислородом. Их основной структурный элемент – ион оксида (оксион), который состоит из атомов кислорода и металлического иона. Ионная связь, обеспечивающая стабильность оксидов металла, является ключевым фактором, определяющим их физические и химические свойства.
Оксиды металла обладают рядом уникальных свойств, включая высокую температуро- и химическую устойчивость, твердость, электропроводность и каталитическую активность. Их физические свойства определяются прежде всего структурой ионов оксида, их зарядом, размерами и формой. Чем меньше размеры ионов, тем выше критическая температура плавления, твердость и кремнистость оксидов.
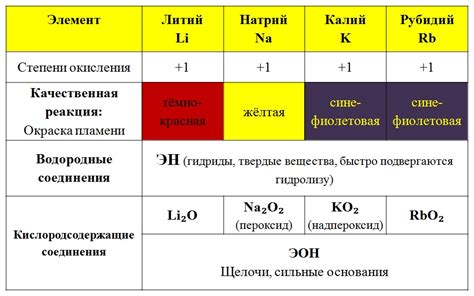
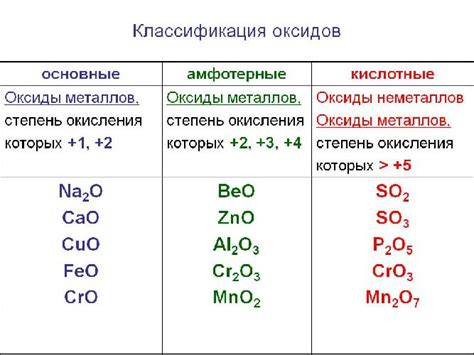
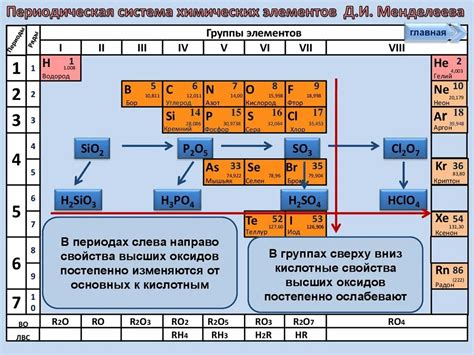
Интересной особенностью оксидов металла является их способность проявлять кислотно-основные свойства. Некоторые из них – оксиды щелочных металлов – образуют водные растворы, которые обладают щелочными свойствами и повышенной щелочности. Другие оксиды – щелочноземельных металлов – образуют растворы, которые проявляют щелочные свойства в небольшой степени. Оксиды переходных металлов, в свою очередь, выражают слабые кислотные свойства, образуя водные растворы с повышенной кислотностью.
Оксиды металла широко используются в промышленности, науке и технологии. Они являются ключевыми компонентами в производстве керамики, стекла, электродов, красок и лаков. Также оксиды металла применяются в процессах очистки воды, электролизе, катализе и аккумуляторных технологиях. Понимание ионной связи и свойств оксидов металла имеет широкое значение для улучшения качества производства и разработки новых материалов и технологий.
Роль оксидов металла в химии
Оксиды металла играют важную роль в химии и имеют множество применений. Они являются важными компонентами многих материалов и веществ. Оксиды металла обладают различными свойствами и могут быть как полезными, так и вредными.
Первое, что следует отметить, это то, что оксиды металла образуются при реакции металлов с кислородом. Они представляют собой химические соединения, в которых металл соединяется с кислородом. Эти соединения обычно обладают ионной связью и имеют кристаллическую структуру.
Оксиды металла широко используются в промышленности для производства различных материалов и продуктов. Например, оксиды металла могут быть использованы в качестве катализаторов, присадок для окраски и пигментов, а также в производстве стекла и керамики. Они также могут быть использованы в химической промышленности для получения других соединений металла.
Некоторые оксиды металла имеют важное значение в жизни организмов. Например, оксиды металла играют роль в биохимических процессах организма, таких как дыхание и окислительно-восстановительные реакции. Они также могут быть использованы в качестве добавок в пищу, улучшающих вкус и консистенцию продуктов.
Однако не все оксиды металла безопасны для человека и окружающей среды. Некоторые оксиды металла могут быть токсичными и вызывать различные заболевания, если попадут в организм. Поэтому необходимо использовать оксиды металла с осторожностью и соблюдать меры безопасности при работе с ними.
Таким образом, оксиды металла играют значительную роль в химии и имеют широкий спектр применений. Они являются важными компонентами различных материалов и могут быть полезными при правильном использовании. В то же время, необходимо учитывать их потенциальные опасности и принимать меры предосторожности при работе с ними.
Что такое оксиды металла
Оксиды металла – это химические соединения, состоящие из атомов металла и кислорода. Они образуются при взаимодействии металлов с кислородом воздуха или при окислении металлических элементов. Оксиды металла имеют ярко выраженные ионные свойства и широко используются в различных областях, таких как металлургия, химическая промышленность и электроника.
Оксиды металла обладают рядом характерных свойств. Из-за наличия кислорода в их составе, они часто обладают кислыми свойствами и могут образовывать кислотные соединения. Кроме того, оксиды металла обычно обладают высокой степенью термической и электрической проводимости, что делает их важными компонентами в различных электронных устройствах.
Оксиды металла также могут обладать специфическими свойствами в зависимости от химического состава и структуры. Некоторые из них обладают полупроводниковыми свойствами и используются в производстве солнечных батарей и полупроводниковых приборов. Другие оксиды металла могут образовывать стабильные соединения с другими элементами и широко применяются в качестве катализаторов в различных химических процессах.
Исследование оксидов металла и изучение их свойств имеют важное значение для развития новых материалов и технологий. Эти соединения играют важную роль в многих отраслях промышленности и являются неотъемлемой частью нашей повседневной жизни.
Свойства и строение оксидов металла
Оксиды металла - это химические соединения, состоящие из металла и кислорода. Они обладают рядом уникальных свойств, которые определяются их структурой и ионной связью.
Первое свойство оксидов металла - высокая температура плавления и кипения. Это связано с прочной ионной связью между положительно заряженными металлическими и отрицательно заряженными кислородными ионами. Благодаря этому, оксиды металла обладают высокой термической стабильностью и широким диапазоном рабочих температур.
Второе свойство оксидов металла - хорошая проводимость электричества и тепла. Благодаря наличию свободных электронов в структуре, металлические ионы в оксидах металла способны передвигаться и проводить электрический ток. Кроме того, благодаря ионной связи, оксиды металла обладают хорошей теплопроводностью.
Еще одно свойство оксидов металла - их способность быть растворимыми в воде. Некоторые оксиды металла имеют способность образовывать кислоты, когда растворяются в воде. Это связано с тем, что в растворе положительные металлические ионы образуют гидроксиды, которые обсуждаются, что приводит к образованию кислоты.
Наконец, оксиды металла также могут обладать различными цветами, которые определяются их структурой и наличием примесей. Например, некоторые оксиды металла могут быть красными, синими или желтыми в зависимости от того, какие ионы присутствуют в их структуре.
В целом, свойства и строение оксидов металла обусловлены их химической природой и взаимодействием металла с кислородом. Это делает оксиды металла важными и широко применяемыми в различных областях, включая промышленность, электронику и катализ.
Ионная связь в оксидах металла

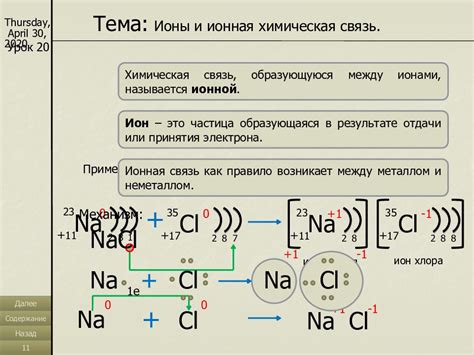
Оксиды металла представляют собой соединения, в которых атомы металла связаны с атомами кислорода. Ионная связь в оксидах металла обусловлена переносом электронов от металлических атомов кислороду. При этом атомы металла теряют электроны и становятся положительно заряженными ионами (катионами), а атомы кислорода приобретают электроны и становятся отрицательно заряженными ионами (анионами).
В оксидах металла ионная связь обеспечивает прочность и твердость вещества. Ионы с противоположными зарядами притягиваются друг к другу и образуют кристаллическую структуру. Эта структура обладает высокой температурой плавления и кипения, что делает оксиды металла твердыми и стойкими в высоких температурах.
Ионная связь в оксидах металла также определяет электрические свойства этих соединений. Благодаря своей ионной природе, оксиды металла обладают высокой электропроводностью в расплавленном состоянии или в растворе. Однако в твердом состоянии оксиды металла не проводят электрический ток, так как ионы занимают фиксированные положения в кристаллической решетке и не могут перемещаться.
Понятие ионной связи в химии
Ионная связь – это вид химической связи, возникающей между атомами, в результате передачи или приобретения электронов, что приводит к образованию ионов положительного и отрицательного заряда. Основой ионной связи является притяжение противоположно заряженных ионов.
Вещества, обладающие ионной связью, обычно имеют высокую температуру плавления и кипения, так как для разрыва ионной связи требуется большое количество энергии. Кроме того, ионные соединения обладают хорошей электропроводностью в расплавленном или растворенном состоянии, так как ионы способны проводить электрический ток.
Ионная связь обладает определенными свойствами, такими как кристаллическая структура, жесткость, хрупкость и хорошая растворимость в воде. Кристаллическая структура ионных соединений обусловлена упорядоченным расположением ионов в решетке. Из-за этого ионные соединения обычно являются твердыми и хрупкими веществами, так как при деформации решетки происходит нарушение электрического равновесия, что приводит к разрушению соединения.
Также важным свойством ионной связи является способность ионов образовывать растворы в воде. Вода хорошо растворяет ионы положительного и отрицательного заряда, что позволяет образовывать растворы ионных соединений. Это объясняется полярностью молекулы воды – одна сторона молекулы обладает отрицательным зарядом, а другая – положительным, что обеспечивает притяжение ионов.
Роль ионной связи в оксидах металла
Оксиды металла - это химические соединения, состоящие из металлического и кислородного атомов. Ионная связь играет важную роль в формировании структуры и свойств этих соединений.
Когда металл и кислород вступают в реакцию, металлический атом отдает одно или несколько электронов кислороду. В результате образуются положительно заряженные ионы металла и отрицательно заряженные ионы кислорода.
Ионная связь возникает в результате притяжения этих противоположно заряженных ионов. Наиболее ярким примером является оксид кальция (CaO), в котором ионы кальция с положительной зарядом Ca2+ связаны с ионами кислорода с отрицательной зарядом O2-.
Ионная связь обладает рядом характерных свойств. Она очень прочная и требует большого количества энергии для разрушения. Кроме того, оксиды металла с ионной связью обычно обладают высокими температурными точками плавления и кипения, а также хорошей растворимостью в воде.
Ионная связь в оксидах металла также влияет на их химическую активность и реакционную способность. Например, оксиды металла могут взаимодействовать с кислотами, образуя соли и воду.
В целом, роль ионной связи в оксидах металла является определяющей, она обеспечивает устойчивость структуры соединений и дает им характеристические свойства. Это важное понимание помогает не только в химических исследованиях, но и в применении оксидов металла в различных отраслях промышленности и технологии.
Физические и химические свойства оксидов металла

Оксиды металла - это соединения, состоящие из атомов металла и кислорода. Они обладают разнообразными физическими и химическими свойствами, которые определяют их использование в различных областях.
Физические свойства оксидов металла включают высокую температуру плавления и кипения, что обусловлено их ионной структурой и сильными электростатическими силами притяжения между атомами. Некоторые оксиды металла имеют металлический блеск, характерный для металлов, что делает их привлекательными для использования в ювелирных украшениях и декоративных изделиях.
Химические свойства оксидов металла определяются их способностью взаимодействовать с другими веществами. Они являются основаниями, т.е. способными реагировать с кислотами, образуя соли и воду. Например, оксид алюминия реагирует с кислотой серной, образуя соль алюминия и воду.
Оксиды металла также являются окислами, т.е. способными вступать в реакции окисления с другими веществами. Они могут участвовать в реакциях горения и окисления, образуя продукты с более высоким содержанием кислорода. Например, оксид железа может реагировать с кислородом из воздуха и образовывать ржавчину.
Оксиды металла также обладают электролитическими свойствами и могут проводить электрический ток. Это делает их полезными в производстве электролитических аккумуляторов и других электротехнических устройствах.
Все эти свойства оксидов металла делают их важными соединениями как в промышленности, так и в научных исследованиях. Они находят применение в различных отраслях, начиная от металлургии и химической промышленности, заканчивая электроникой и энергетикой.
Физические свойства оксидов металла
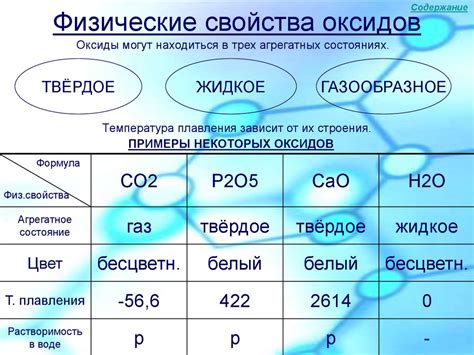
1. Температура плавления: Оксиды металла обладают высокой температурой плавления. Это связано с особенностями ионной связи, которая является основной типом связи в этих соединениях. Высокая температура плавления позволяет оксидам металла являться стабильными в условиях высоких температур и обладать хорошей термической стабильностью.
2. Теплопроводность: Оксиды металла обычно хорошо проводят тепло. Это связано с наличием свободных электронов, которые могут перемещаться по решетке и передавать энергию. Такая высокая теплопроводность делает оксиды металла эффективными теплоотводами и обуславливает их широкое применение в различных отраслях промышленности.
3. Электрическая проводимость: Оксиды металла обладают различной электрической проводимостью в зависимости от структуры и валентности ионов металла. Некоторые оксиды металла являются полупроводниками, в то время как другие проявляют свойства изоляторов. Это обусловлено различием в энергетической зоне проводимости и валентной зоне, что позволяет или препятствует передаче заряда.
4. Плотность: Оксиды металла обычно обладают высокой плотностью из-за компактной структуры ионной связи. Это делает оксиды металла тяжелыми и дает им высокую плотность в твердом состоянии. Высокая плотность имеет практическое значение, так как она влияет на механическую прочность и физические свойства оксидов металла.
Химические свойства оксидов металла

Оксиды металла обладают рядом химических свойств, которые определяют их реакционную способность и применение в различных областях. Важными химическими свойствами оксидов металла являются их способность к растворению в различных средах, реакция с кислородом и кислотами, а также возможность образования солей и оснований.
Растворимость оксидов металла зависит от их структуры и заряда ионов. Некоторые оксиды металла растворяются в воде, образуя щелочные растворы, в то время как другие оксиды металла не растворяются в воде, но могут растворяться в кислотах или других растворителях.
Реакция оксидов металла с кислородом является одной из основных химических реакций, которые могут происходить с оксидами металла. При нагревании оксид металла может реагировать с кислородом, образуя кислородные газы или перекиси. Некоторые оксиды металла, такие как оксид железа, обладают катализирующими свойствами и могут реагировать с кислородом в присутствии других соединений.
Оксиды металла также могут реагировать с кислотами, образуя соли и воду. Эта реакция происходит из-за свойства оксидов металла быть основаниями, которые способны принимать протоны от кислот. Также оксиды металла могут претерпевать взаимодействие с другими веществами, образуя смеси или соединения с уникальными свойствами.
Кроме того, оксиды металла могут быть использованы для создания различных материалов, таких как керамика, стекло, катализаторы и полупроводники. Их свойства и реакционная способность открыли широкий спектр применений оксидов металла в промышленности и научных исследованиях.
Вопрос-ответ

Какие свойства имеют оксиды металлов?
Оксиды металлов обладают рядом характерных свойств. Они соединяют металл с кислородом и могут быть как щелочными, так и амфотерными. Оксиды металлов также имеют высокую температуру плавления и кипения, а также высокую жаропрочность.
Что такое ионная связь в оксидах металлов?
Ионная связь в оксидах металлов является типом химической связи, где ионы металла и кислорода притягиваются друг к другу с помощью электростатических сил. Металл отдает электроны кислороду, образуя положительные ионы, тогда как кислород получает электроны и образует отрицательные ионы. Эти положительные и отрицательные ионы притягиваются друг к другу и образуют устойчивую решетчатую структуру.
Какие металлы образуют оксиды?
Практически все металлы могут образовывать оксиды. Некоторые примеры включают алюминий, железо, медь, свинец, никель и титан. Каждый металл может образовывать различные оксиды с разными степенями окисления.
Каково значение оксидов металлов для нашей жизни?
Оксиды металлов имеют огромное значение в нашей жизни. Они используются в различных отраслях, таких как металлургия, электроника, строительство и многих других. Например, оксид алюминия (алюминий) используется в производстве алюминиевых конструкций и материалов, оксид железа (железо) широко применяется в производстве стали и магнитов. Кроме того, некоторые оксиды металлов имеют медицинское и фармацевтическое применение.
