Оксиды амфотерных металлов – это химические соединения, способные проявлять реакцию как с кислотами, так и с щелочами. Этот класс соединений включает в себя такие элементы, как алюминий, цинк, олово и другие. Реакция этих оксидов с водой является особым процессом, который имеет свои принципы и особенности.
Оксиды амфотерных металлов реагируют с водой, образуя соответствующие гидроксиды. Например, оксид алюминия (Al2O3) при контакте с водой превращается в гидроксид алюминия (Al(OH)3). Такая реакция обусловлена наличием амфотерных свойств металла, то есть способности проявлять как кислотные, так и основные свойства.
Процесс реакции оксидов амфотерных металлов с водой идет с выделением тепла. Такая экзотермическая реакция проходит с проникновением воды во внутреннюю структуру оксида и последующим образованием гидроксида. При этом происходит распад связей в структуре оксида и повторное образование новых связей при формировании гидроксида.
Примечательный пример реакции оксида амфотерного металла с водой – это реакция оксида цинка (ZnO). В результате этой реакции образуется гидроксид цинка (Zn(OH)2) и выделяется значительное количество тепла. Оксид цинка обладает как кислотными, так и основными свойствами, поэтому может реагировать как с кислотами, так и с щелочами.
Реакция оксидов амфотерных металлов с водой имеет промышленное значение. Некоторые оксиды используются для очистки воды от загрязнений и обеззараживания. Также, такие реакции могут быть полезны при получении гидроксидов амфотерных металлов, которые широко применяются в различных производствах, включая строительство, косметику и электронику.
Оксиды амфотерных металлов и их реакция с водой
Оксиды амфотерных металлов представляют собой химические соединения, которые обладают способностью взаимодействовать как с кислотами, так и с щелочами. Это свойство обусловлено наличием свободных электронных пар на поверхности частиц оксидов, что позволяет им принимать или отдавать протоны в химических реакциях.
Реакция оксидов амфотерных металлов с водой может протекать различными путями в зависимости от условий. В нейтральной среде оксиды амфотерных металлов не проявляют сильной активности, но при изменении pH окружающей среды они могут проявить свои амфотерные свойства.
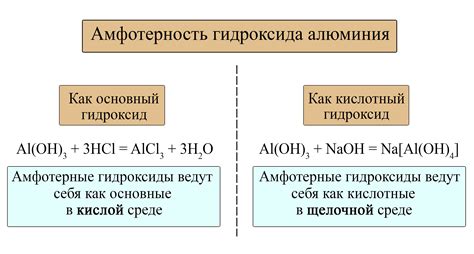
Например, оксид алюминия (Al2O3) является одним из наиболее известных амфотерных оксидов. При реакции с водой он может выступать как в качестве основания, образуя гидроксид алюминия (Al(OH)3), так и в качестве кислоты, образуя алюминаты (Al(OH)4-) в растворе. Это позволяет оксиду алюминия поддерживать буферные свойства в системах, где требуется постоянное pH.
Важно отметить, что не все оксиды амфотерных металлов обладают сильными амфотерными свойствами. Некоторые оксиды, такие как оксид железа (Fe2O3) или оксид цинка (ZnO), проявляют амфотерность только при высоких концентрациях или в определенных условиях.
Определение и свойства оксидов амфотерных металлов

Амфотерные металлы - это элементы, оксиды которых реагируют с водой и кислотами, проявляя себя как основание или кислота в зависимости от условий. Одним из хороших примеров амфотерного металла является алюминий.
Оксиды амфотерных металлов - это соединения, состоящие из металла и кислорода. Они могут проявлять кислотные или основные свойства в реакции с водой. Например, оксид алюминия (Al2O3) может реагировать с водой как с кислотой, образуя алюминиевую кислоту, а также как с основанием, образуя гидроксид алюминия.
Свойства оксидов амфотерных металлов зависят от электрохимической активности металла и его способности принимать или отдавать протоны. Такие оксиды обладают особой способностью изменять свое поведение в зависимости от среды реакции.
Оксиды амфотерных металлов обычно образуют щелочные растворы, когда они реагируют с кислотой, и образуют кислотные растворы, когда они реагируют с основанием. Это свойство делает их важными в различных химических процессах и применениях, таких как производство кожи, керамики, стекла и др.
Определение и свойства оксидов амфотерных металлов являются важным аспектом изучения химии и обеспечивают понимание их взаимодействия с водой и другими веществами с целью использования их в различных химических процессах и промышленности.
Примеры оксидов амфотерных металлов
Амфотерные металлы - это металлы, способные реагировать со средой как в кислых, так и в щелочных условиях. Они обладают свойством образовывать оксиды, которые могут быть и кислотными, и основными. Вот некоторые примеры оксидов амфотерных металлов:
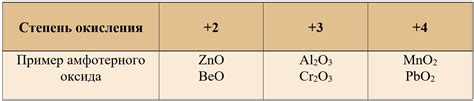
- Алюминий оксид (Al2O3) - это типичный пример амфотерного оксида. Он может реагировать как с кислотами, так и с щелочами. С растворами кислот алюминий оксид образует соли алюмината, а с щелочами - гидроксид алюминия.
- Цинковый оксид (ZnO) - также является амфотерным оксидом. Он может действовать как кислый оксид, образуя с кислотами соли цинкатов, и как щелочной оксид, образуя с щелочами гидроксид цинка.
- Свинцовый оксид (PbO) - еще один пример амфотерного оксида. Он может образовывать соли свинцоватых кислот при реакции с кислотами и гидроксид свинца при взаимодействии с щелочами.
Это лишь некоторые примеры оксидов амфотерных металлов. Важно отметить, что реакция оксидов с водой может быть различной в зависимости от условий и конкретного оксида. Эти свойства амфотерных оксидов играют важную роль во многих процессах и химических реакциях, а их понимание важно для изучения химии металлов.
Химические реакции оксидов амфотерных металлов с водой

Оксиды амфотерных металлов - это химические соединения, которые обладают способностью реагировать как с кислыми, так и с щелочными средами. Эти соединения образуются при окислении амфотерных металлов и взаимодействии их оксида с водой.
Вода обладает способностью как донора, так и акцептора протонов. Поэтому оксиды амфотерных металлов могут взаимодействовать с водой и образовывать соответствующие гидроксиды.
Примерами амфотерных металлов являются алюминий (Al), цинк (Zn), железо (Fe), медь (Cu), свинец (Pb) и другие. Когда оксиды этих металлов реагируют с водой, происходит химическая реакция, в результате которой образуется гидроксид металла и освобождаются ионы гидроксония (H3O+) или гидроксидионы (OH-).
- Реакция оксида алюминия (Al2O3) с водой приводит к образованию гидроксида алюминия (Al(OH)3):
| Al2O3 | + | 3H2O | → | 2Al(OH)3 |
|---|
- Реакция оксида цинка (ZnO) с водой приводит к образованию гидроксида цинка (Zn(OH)2):
| ZnO | + | 2H2O | → | Zn(OH)2 |
|---|
- Реакция оксида железа (Fe2O3) с водой приводит к образованию гидроксида железа(III) (Fe(OH)3):
| Fe2O3 | + | 3H2O | → | 2Fe(OH)3 |
|---|
Таким образом, реакция оксидов амфотерных металлов с водой приводит к образованию соответствующих гидроксидов, что является характерным свойством амфотерных металлов.
Влияние реакции оксидов амфотерных металлов на окружающую среду

Реакция оксидов амфотерных металлов с водой может иметь различные последствия для окружающей среды. Эти оксиды обладают способностью взаимодействовать как с кислотами, так и с щелочами, что делает их особенно важными в химических процессах.
В результате реакции оксидов амфотерных металлов с водой образуются ионы гидроксида и соответствующих металлов. Гидроксиды амфотерных металлов обладают щелочными свойствами и способны изменять pH среды. Это может иметь значительное влияние на окружающую среду, особенно в случае образования больших количеств подобных гидроксидов.
Реакция оксидов амфотерных металлов с водой также может приводить к образованию осадков, таких как гидроксиды или оксиды металлов. Осадки этих соединений могут накапливаться в водных системах, что ведет к изменению их химического и экологического состава. Это может оказывать влияние на рыбу и другие водные организмы, а также на качество питьевой воды.
Кроме того, оксиды амфотерных металлов могут быть высокотоксичными и вызывать негативное воздействие на окружающую среду и живые организмы. Некоторые из этих оксидов, такие как оксид свинца или оксид меди, являются веществами, которые могут накапливаться в организмах и вызывать серьезные заболевания.
Поэтому важно учитывать потенциальное влияние реакции оксидов амфотерных металлов на окружающую среду при их использовании в различных процессах и при работе с подобными веществами. Необходимо принимать меры по контролю и уменьшению выбросов данных оксидов, а также проводить мониторинг их содержания в окружающей среде, чтобы минимизировать негативные последствия для экосистем и здоровья людей.
Особенности взаимодействия оксидов амфотерных металлов с водой

Оксиды амфотерных металлов – это вещества, которые могут реагировать как с кислотами, так и с основаниями. Взаимодействие этих оксидов с водой имеет свои особенности.
Вода может действовать как кислота или основание в реакции соответствующего оксида. Например, оксид алюминия (Al2O3) реагирует с водой и образует алюминат (Al(OH)4-), действуя как кислота:
Al2O3 + 3H2O → 2Al(OH)4-
С другой стороны, оксиды амфотерных металлов могут вступать в реакцию с водой как основания. Например, оксид цинка (ZnO) реагирует с водой и образует гидроксид цинка, действуя как основание:
ZnO + H2O → Zn(OH)2
При этом образование гидроксидов амфотерных металлов сопровождается выделением теплоты, так как процесс реакции является экзотермическим.
Важно отметить, что степень амфотерности оксидов металлов может быть разной. Некоторые оксиды проявляют свойства и кислот, и оснований в большей степени, чем другие. Например, оксид алюминия взаимодействует с водой как кислота, проявляя свои кислотные свойства более активно.
Таким образом, взаимодействие оксидов амфотерных металлов с водой обладает своими особенностями, которые связаны с их способностью проявлять свойства как кислот, так и оснований.
Вопрос-ответ

Какие металлы считаются амфотерными и почему?
Амфотерными металлами считаются те, которые могут проявлять и кислотные, и основные свойства. Это связано с возможностью образования ионов различной степени окисления, которые взаимодействуют с водой как окислители (получая электроны) или как восстановители (отдавая электроны).
Что происходит при реакции оксидов амфотерных металлов с водой?
При реакции оксидов амфотерных металлов с водой образуются соответствующие гидроксиды металлов. Реакционные условия и характер оксида металла определяют, будет ли реакция проходить с образованием кислотного или щелочного раствора.
Каковы особенности реакции оксида амфотерного металла алюминия с водой?
Особенностью реакции оксида амфотерного металла алюминия с водой является образование щелочного раствора. Это происходит из-за того, что оксид алюминия реагирует с водой, образуя гидроксид алюминия и выделяя гидроген.
