Оксиды щелочных металлов являются важными соединениями в химии и обладают широким спектром применений в различных отраслях промышленности. Одним из интересных аспектов взаимодействия оксидов щелочных металлов является их взаимодействие с кислородом.
Кислород является одним из наиболее химически активных элементов и способен вступать в реакцию с многими веществами. Взаимодействие оксидов щелочных металлов с кислородом приводит к образованию оксидов щелочных металлов в высокоокисленном состоянии.
Оксиды щелочных металлов характеризуются высокой электроотрицательностью, что делает их сильными окислителями. В результате взаимодействия оксидов щелочных металлов с кислородом, происходит передача электронов от оксида на кислород, сопровождающаяся образованием ионов щелочного металла и оксидов кислорода с более высокой степенью окисления.
Взаимодействие оксида щелочного металла с кислородом может протекать при различных условиях: при повышенных температурах, при высоком давлении кислорода или при воздействии электрического тока. Результатом такого взаимодействия может быть образование различных оксидов щелочных металлов, обладающих определенными свойствами и химической активностью.
Описание оксида щелочного металла

Оксид щелочного металла – неорганическое соединение, состоящее из атомов щелочного металла (либо его иона) и атомов кислорода. Щелочные металлы включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Оксиды щелочных металлов имеют различные химические и физические свойства, но обычно являются твердыми, кристаллическими веществами.
Оксиды щелочного металла обладают высокой щелочной активностью, что обусловлено наличием ионов металла, которые взаимодействуют с водой или кислотами. Реакция оксида щелочного металла с водой приводит к образованию оснований, а реакция с кислотами приводит к образованию солей. Например, оксид натрия (Na2O) реагирует с водой, образуя щелочное растворимое вещество – гидроксид натрия (NaOH).
Другие свойства оксидов щелочных металлов включают их высокие температуры плавления и кипения, хорошую проводимость электричества в расплавленном состоянии, а также способность образовывать ионы металла. Оксиды щелочных металлов также часто используются в качестве катализаторов, чтобы ускорить химические реакции и облегчить их протекание.
- Оксиды щелочных металлов обладают высокой щелочной активностью и реагируют с водой или кислотами.
- Их основная реакция – образование оснований или солей.
- Оксиды щелочных металлов имеют высокие температуры плавления и кипения, обладают хорошей проводимостью электричества в расплавленном состоянии.
- Они способны образовывать ионы металла и широко используются в качестве катализаторов для ускорения химических реакций.
Природа реакции с кислородом
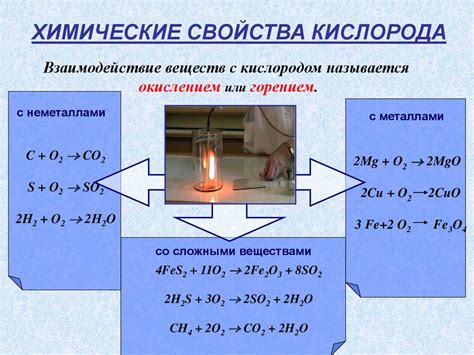
Взаимодействие оксида щелочного металла с кислородом представляет собой реакцию окисления, при которой между металлом и кислородом образуется химическая связь. Реакция протекает на поверхности металла, где активные атомы металла соединяются с кислородом из воздуха.
Оксид щелочного металла многие известны своими окислительными свойствами. Взаимодействие оксида щелочного металла с кислородом приводит к образованию оксидного соединения, в котором металл находится в более высокой степени окисления. Например, при взаимодействии кислорода с оксидом натрия (Na2O) образуется оксид натрия (Na2O2), где натрий находится в состоянии окисления +1.
Взаимодействие оксида щелочного металла с кислородом происходит в условиях высокой температуры, что обусловлено высокой энергией активации реакции. В результате реакции образуется теплота, которая может быть использована в промышленности. Например, оксид натрия может быть использован в процессе получения соды и щелочи.
Природа реакции с кислородом зависит от химической активности щелочных металлов. Способность металла вступать в реакцию с кислородом может быть определена по таблице активностей металлов. Наиболее активными металлами являются калий и натрий, которые легко реагируют с кислородом. Более инертные металлы, такие как литий, реагируют с кислородом медленнее.
Реакционная способность оксида щелочного металла

Оксиды щелочных металлов проявляют высокую реакционную способность при взаимодействии с кислородом. Эта химическая реакция называется окислением. Как известно, щелочные металлы входят в первую группу периодической системы, и их оксиды имеют общую формулу M2O, где M обозначает металл.
При контакте с кислородом оксиды щелочных металлов проявляют высокую активность и способность быстро реагировать. В результате процесса окисления, щелочные металлы образуют оксиды с высокой степенью окисления металла. Например, натрий (Na) при окислении образует оксид натрия (Na2O), калий (K) - оксид калия (K2O) и т.д.
Реакция окисления оксидов щелочных металлов с кислородом протекает очень интенсивно в силу высокой активности щелочных металлов. В результате этого процесса образуется щелочные пероксиды, в которых металл имеет максимальную степень окисления. Например, пероксид натрия (Na2O2) и пероксид калия (K2O2) являются типичными продуктами реакции окисления.
Реакционная способность оксида щелочного металла с кислородом обусловлена электрохимическими свойствами щелочных металлов. Эти металлы легко отдают электроны, что позволяет им активно участвовать в реакциях окисления. Такая способность оксидов щелочных металлов взаимодействовать с кислородом находит широкое применение в различных химических процессах и промышленных технологиях.
Физические свойства полученного соединения
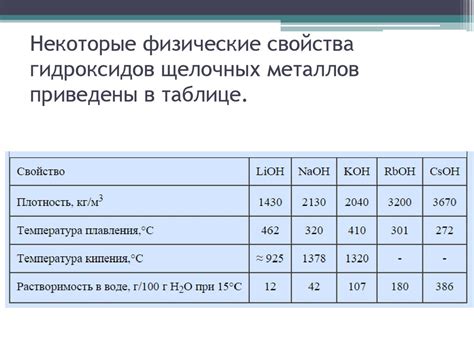
Полученное соединение в виде оксида щелочного металла обладает рядом характерных физических свойств, которые определяют его структуру и влияют на его взаимодействие с другими веществами.
Первое из этих свойств - высокая температура плавления. Оксид щелочного металла имеет высокую температуру плавления, что связано с прочными межатомными связями в его кристаллической решетке.
Второе свойство - ограниченная растворимость в воде. Оксид щелочного металла обычно плохо растворяется в воде, что проявляется в низкой степени диссоциации на ионы в растворе.
Третье имеет место упругость соединения. Оксид щелочного металла является твердым веществом, обладающим определенной упругостью. Это связано с наличием прочных связей между атомами в его кристаллической структуре.
Четвертое свойство - ярко выраженный собственный цвет соединения. Оксид щелочного металла может иметь различные цвета, которые определяются его электронной структурой и способностью поглощать и испускать свет при взаимодействии с электромагнитным излучением.
Наконец, пятое свойство - высокая плотность соединения. Оксид щелочного металла обладает высокой плотностью благодаря компактной упаковке его молекул или ионов в кристаллической структуре.
Применение оксида щелочного металла с кислородом
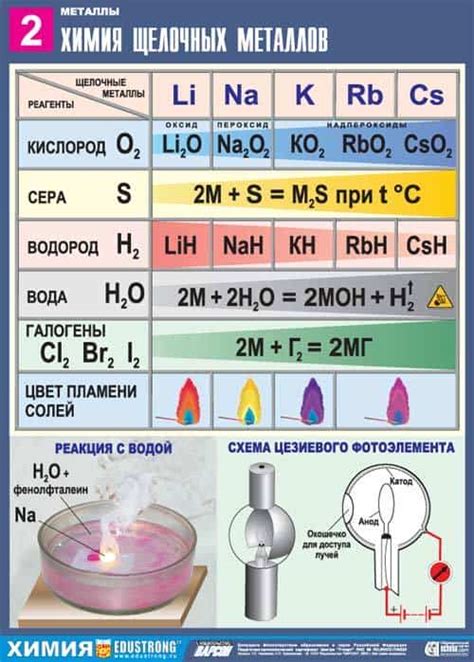
Оксиды щелочных металлов, такие как оксид натрия, оксид калия и оксид лития, широко применяются в различных областях человеческой деятельности.
В промышленности оксиды щелочных металлов используются для производства стекла, керамики и других материалов. Оксид натрия, например, является основным компонентом стекла, обладающего высокой прозрачностью и прочностью.
В металлургии оксиды щелочных металлов применяются для очистки и обработки металлических поверхностей. Оксид натрия, оксид калия и оксид лития могут использоваться в качестве флюсов при сварке и пайке, снижая плотность поверхностной пленки и улучшая сцепление металлов.
В производстве щелочей оксиды щелочных металлов служат основным сырьем для получения гидроксидов, таких как гидроксид натрия и гидроксид калия. Гидроксиды щелочных металлов используются в химической промышленности для производства мыла, стекловолокна, целлюлозы и других продуктов.
В электрохимии оксиды щелочных металлов служат активными компонентами катодов в различных типах аккумуляторных батарей. Оксид натрия, например, используется в натриевых аккумуляторах, которые используются в электростанциях и солнечных батареях.
Таким образом, оксиды щелочных металлов с кислородом находят широкое применение в различных сферах, от промышленности до электрохимии, благодаря своим уникальным физическим и химическим свойствам.
Вопрос-ответ

Какие металлы относятся к щелочным металлам?
К щелочным металлам относятся литий, натрий, калий, рубидий и цезий.
Каким образом оксид щелочного металла реагирует с кислородом?
Оксид щелочного металла реагирует с кислородом, образуя основание.
