Оксид с полуметаллом - это химическое соединение, состоящее из атомов полуметалла и кислорода. В зависимости от сорта полуметалла, такие оксиды могут иметь различные физические и химические свойства. Оксиды с полуметаллами широко распространены в природе и играют важную роль в различных сферах науки и промышленности.
Одно из наиболее известных свойств оксидов с полуметаллами - их полупроводниковая природа. Полуметаллы, такие как германий и мышьяк, обладают особой структурой, в которой ионы полуметалла образуют в кристаллической решетке локальные зоны полупроводнической активности. В результате, оксиды с такими полуметаллами также обладают полупроводниковыми свойствами и могут использоваться в электронике и солнечных батареях.
Кроме полупроводниковых свойств, оксиды с полуметаллами также обладают высокой химической активностью. Это связано с тем, что полуметаллы имеют необычное расположение в периодической таблице, находясь между металлами и неметаллами. Такая позиция дает им возможность проявлять свойства как металлов, так и неметаллов, что делает их оксиды химически активными соединениями, способными участвовать в разнообразных химических реакциях.
Одним из применений оксидов с полуметаллами является их использование в производстве полупроводниковых кристаллов и микросхем. Кристаллы, содержащие оксиды полуметаллов, обладают высокими электропроводящими свойствами и могут использоваться для создания различных электронных устройств, таких как транзисторы, диоды и интегральные схемы. Благодаря своей химической активности, оксиды с полуметаллами также используются в качестве катализаторов химических реакций, а также в производстве стекла и керамики.
В заключение, оксиды с полуметаллами - это важные химические соединения, обладающие уникальными свойствами и широким спектром применения. Их полупроводниковые свойства и химическая активность делают их незаменимыми в многих отраслях науки и промышленности. Благодаря дальнейшему изучению свойств и применения оксидов с полуметаллами, возможно открытие новых технологий и материалов, способных преобразовать нашу жизнь и мир вокруг нас.
Оксид с полуметаллом:
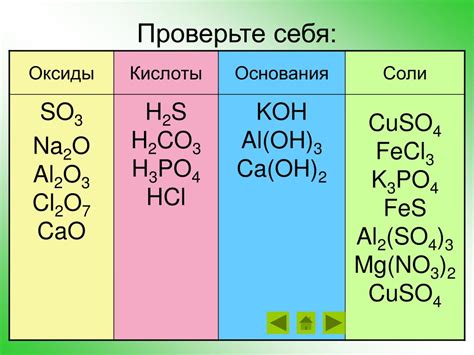
Оксид с полуметаллом - химическое соединение, состоящее из атомов полуметалла и кислорода. Полуметаллы - это элементы, имеющие свойства как металлов, так и неметаллов. В состав оксида с полуметаллом входят ионы полуметалла в одной или нескольких степенях окисления, а также кислородные ионы.
Оксиды с полуметаллом обладают различными физическими и химическими свойствами. Они могут быть как кислотными (оксиды, реагирующие с водой и образующие кислоты), так и основными (оксиды, реагирующие с водой и образующие основания). Помимо этого, оксиды с полуметаллом могут проявлять амфотерные свойства, то есть они могут взаимодействовать как с кислотами, так и с основаниями.
Оксиды с полуметаллом имеют разнообразные применения. Они используются в качестве катализаторов в химической промышленности, в производстве электроники и полупроводников, в медицине и фармацевтике. Например, они применяются для синтеза различных органических соединений, создания специальных покрытий на поверхностях материалов, а также для очистки воздуха и воды от загрязнений.
Примерами оксидов с полуметаллом являются оксид кремния (SiO2), оксид алюминия (Al2O3), оксид азота (NO2) и многие другие.
Свойства
Оксиды с полуметаллами обладают рядом характерных свойств, которые определяют их особенности и применение в различных областях.
Физические свойства:
- Оксиды с полуметаллами обычно обладают достаточно высокой температурой плавления и кипения, что делает их полезными в высокотемпературных процессах.
- Некоторые оксиды имеют кристаллическую структуру и образуют яркие кристаллы, которые могут использоваться в ювелирной промышленности.
- Оксиды с полуметаллами обычно являются электронными проводниками и обладают полупроводниковыми свойствами. Это делает их необходимыми для производства электронных компонентов.
Химические свойства:
- Оксиды с полуметаллами могут реагировать с водой, образуя кислоты или основания. Это делает их важными в химической промышленности и процессах очистки воды.
- Некоторые оксиды с полуметаллами могут действовать как катализаторы химических реакций, повышая их скорость и эффективность.
- Оксиды с полуметаллами могут образовывать стабильные соединения с другими элементами, что делает их полезными в различных областях науки и технологии.
Физико-химические свойства:
- Оксиды с полуметаллами могут образовывать различные структуры, такие как слоистые, аморфные или поликристаллические. Это позволяет им применяться в различных материалах и покрытиях.
- Некоторые оксиды с полуметаллами обладают уникальными оптическими свойствами, такими как фотолюминесценция или эффект Фара. Это делает их полезными в оптической промышленности и электронике.
- Оксиды с полуметаллами могут быть токсичными или радиоактивными веществами, поэтому требуется особая осторожность при обращении с ними.
Применение

Оксиды с полуметаллами находят широкое применение в различных областях науки и техники.
- Электроника: оксиды с полуметаллами используются в производстве полупроводниковых материалов. Например, оксид антимония дополняет полупроводники, улучшая их электрические свойства.
- Химическая промышленность: оксиды с полуметаллами используются как катализаторы в различных химических реакциях. Оксид бисмута, например, используется в производстве пластмасс.
- Медицина: оксиды с полуметаллами находят применение в медицине. Некоторые из них используются в производстве лекарственных препаратов. Например, оксид висмута используется для лечения язв желудка и двенадцатиперстной кишки.
- Энергетика: оксиды с полуметаллами играют важную роль в области энергетики. Например, оксид висмута используется в составе термоэлектрических материалов для преобразования тепловой энергии в электрическую.
В целом, оксиды с полуметаллами имеют широкий спектр применения и являются важными компонентами различных технологий и промышленных процессов.
Химический состав
Оксиды с полуметаллами представляют собой химические соединения, состоящие из металла и кислорода. В зависимости от валентности полуметалла в оксиде, может меняться его химический состав и свойства.
Примерами таких оксидов являются оксиды серы (SO2, SO3), арсения (As2O3, As2O5), селена (SeO2, SeO3) и теллура (TeO2, TeO3). Эти вещества обладают высокой токсичностью и являются основными компонентами в производстве неорганических кислот, промышленных реагентов и других химических соединений.
Химический состав оксидов определяется соотношением молекул кислорода и полуметалла. Например, оксид серы SO2 состоит из одной молекулы кислорода и двух молекул серы, а оксид арсения As2O3 состоит из трех молекул кислорода и двух молекул арсения.
Оксиды с полуметаллами могут образовывать различные соединения с другими химическими элементами. Например, оксид серы может соединяться с водой и образовывать сульфиты и сульфаты.
Химический состав оксидов является основным фактором, влияющим на их свойства и применение в различных областях науки и промышленности.
Физические свойства

Оксид с полуметаллом обладает рядом характеристик, связанных с его физическими свойствами.
Точка плавления: Оксиды с полуметаллами обычно обладают высокой точкой плавления. Это связано с их кристаллической структурой и взаимодействием между атомами. Например, у оксида селена (SeO2) точка плавления составляет около 340°C, а у оксида серы (SO2) – около -75°C.
Цвет и прозрачность: Физические свойства оксидов с полуметаллами также определяют их цвет и прозрачность. Например, оксид арсения (As2O3) обычно имеет белый цвет и является прозрачным, а оксид азота (NO2) имеет красно-коричневую окраску и является непрозрачным.
Плотность и состояние вещества: Оксиды с полуметаллами могут находиться в различных состояниях вещества в зависимости от давления и температуры. Например, оксид аллюминия (Al2O3) имеет плотность около 3,97 г/см³ и находится в твердом состоянии при комнатной температуре и нормальном давлении.
Растворимость: Оксиды с полуметаллами могут быть как растворимыми в воде, так и нерастворимыми. Например, оксид азота (NO2) растворяется в воде, образуя азотную кислоту, а оксид кремния (SiO2) практически нерастворим в воде.
Проводимость: Некоторые оксиды с полуметаллами могут обладать электропроводностью. Например, оксид серы (SO2) может проводить электрический ток в специфических условиях.
Таким образом, физические свойства оксидов с полуметаллами определяют их химическое и физическое поведение, а также применение в различных областях науки и техники.
Химические свойства

1. Реакция с кислородом: Оксид с полуметаллом может вступать в реакцию с кислородом, образуя кислородные анионы. Например, оксид арсения (As2O3) может реагировать с кислородом, образуя анион AsO4^3-. Эта реакция широко используется в синтезе кислородсодержащих соединений.
2. Реакция с кислотами: Оксиды с полуметаллом могут взаимодействовать с кислотами, образуя соли. Например, оксид антимония (Sb2O3) реагирует с соляной кислотой (HCl) и образует хлорид антимония (SbCl3). Эта реакция используется в процессе получения солей полуметалла.
3. Реакция с щелочами: Оксиды с полуметаллом могут реагировать с щелочами, образуя гидроксиды. Например, оксид галлия (Ga2O3) реагирует с гидроксидом натрия (NaOH) и образует гидроксид галлия (Ga(OH)3). Эта реакция используется в процессе получения гидроксидов полуметалла.
4. Реакция с галогенами: Оксиды с полуметаллом могут взаимодействовать с галогенами, образуя галогениды. Например, оксид серы (SO2) может реагировать с хлором (Cl2), образуя хлорид серы (SO2Cl2). Эта реакция используется в процессе получения галогенидов полуметалла.
5. Реакция с водой: Некоторые оксиды с полуметаллом могут реагировать с водой, образуя кислоты или щелочи. Например, оксид алюминия (Al2O3) может реагировать с водой, образуя гидроксид алюминия (Al(OH)3). Эта реакция является основой для получения гидроксидов полуметалла.
6. Реакция с другими оксидами: Оксиды с полуметаллом могут взаимодействовать друг с другом, образуя смеси оксидов. Например, оксид сурьмы (Sb2O3) может реагировать с оксидом ртутной (HgO) и образовывать сурьмаоксид ртутный (Sb2O5·HgO). Эта реакция может привести к образованию более сложных соединений.
Токсичность и безопасность

Оксиды с полуметаллами могут обладать токсичными свойствами, которые могут представлять опасность для человека и окружающей среды. Эти вещества могут быть вредными при попадании в организм через дыхание, пищу или контакт с кожей.
Некоторые оксиды, такие как оксид азота или оксид серы, могут вызывать раздражение дыхательных путей, а также приводить к возникновению проблем со здоровьем, такими как астма или хронические заболевания легких.
Другие оксиды с полуметаллами, такие как оксид свинца или оксид ртути, могут быть токсичными для органов и нервной системы. Они могут проникать в организм через дыхание или пищу, и накапливаться в тканях, вызывая различные проблемы со здоровьем, включая отравление.
Для безопасного обращения с оксидами полуметаллов необходимо соблюдать определенные меры предосторожности. Работники, занимающиеся с данными веществами, должны использовать специальные средства индивидуальной защиты, такие как маски, перчатки и средства защиты глаз. Также необходимо проводить работу с оксидами в специально оборудованных помещениях или под вытяжной вентиляцией, чтобы предотвратить их попадание в атмосферу и окружающую среду.
Правильное хранение и утилизация оксидов полуметаллов также играют важную роль в обеспечении безопасности. Вещества должны храниться в надежных и герметичных контейнерах, чтобы предотвратить их утечку или распространение. Утилизация этих веществ должна проводиться в соответствии с правилами и нормативными документами, чтобы избежать негативного воздействия на окружающую среду и здоровье людей.
Вопрос-ответ

Какие свойства обладает оксид с полуметаллом?
Оксид с полуметаллом обладает рядом свойств, включая высокую термическую и электрическую проводимость, способность к термической и электролитической стабильности, а также возможность образования кристаллической решетки.
Какие полуметаллы могут образовывать оксиды?
Некоторые из наиболее распространенных полуметаллов, образующих оксиды, включают германий, антимон и теллур. Эти полуметаллы образуют оксиды, которые обладают уникальными свойствами и могут использоваться в различных областях промышленности.
Какие применения имеют оксиды с полуметаллами?
Оксиды с полуметаллами имеют широкий спектр применений. Например, оксид германия используется в оптоэлектронике, оксид антимона применяется в производстве пластмасс и пигментов, а оксид теллура применяется в производстве термоэлектрических материалов и солнечных батарей.
Каков химический состав оксида с полуметаллом?
Химический состав оксида с полуметаллом зависит от конкретного полуметалла. Например, оксид германия имеет формулу GeO2, оксид антимона - Sb2O3, а оксид теллура - TeO2. Это основные оксиды, которые образуются при взаимодействии полуметаллов с кислородом.
