Оксиды с разными степенями окисления металла имеют различные свойства и реактивность. Но существуют и такие оксиды, в которых металл обладает наименьшей положительной степенью окисления и проявляет амфотерные свойства. Оксиды с амфотерными свойствами способны проявлять и кислотные, и основные свойства в химических реакциях. Особый интерес представляет оксид с наименьшей положительной степенью окисления металла, так как он обладает уникальными химическими свойствами.
Амфотерные свойства оксида возникают благодаря наличию в его структуре особого типа связи — металл-кислородная связь. Она обусловлена тем, что металл в оксиде имеет наименьшую положительную степень окисления и поэтому находится в состоянии быть одновременно и акцептором, и донором электронов. Это позволяет ему взаимодействовать как с кислотами, так и с основаниями.
Оксид с наименьшей положительной степенью окисления металла может реагировать с кислотами, образуя соли, и с основаниями, образуя сложные основные анионы.
Проявление амфотерных свойств оксида с наименьшей положительной степенью окисления металла имеет важное значение с практической точки зрения. Такие оксиды могут использоваться в промышленности для получения различных продуктов, а также в качестве катализаторов в различных химических реакциях. Изучение и понимание амфотерных свойств таких оксидов является важным направлением в химической науке и имеет большое значение для развития новых технологий и материалов.
Определение и общая информация

Амфотерные свойства оксида с наименьшей положительной степенью окисления металла связаны с его способностью реагировать как с кислотами, так и с щелочами. Оксиды это химические соединения, состоящие из металлического и неметаллического элементов, в которых металл является катионом, а неметалл анионом.
Оксиды, обладающие амфотерными свойствами, способны реагировать и проявлять как кислотные, так и щелочные свойства в зависимости от условий. Если оксид реагирует с кислотой, он действует как основание и образует соль и воду. Если же оксид реагирует с щелочью, то он ведет себя как кислота и образует соль и воду.
Наименьшая положительная степень окисления металла в оксиде говорит о том, что металл участвует в окислительно-восстановительных реакциях с меньшей силой. Такие оксиды могут иметь как кислотные, так и щелочные свойства, в зависимости от их реакции с различными соединениями.
Амфотерные оксиды играют важную роль в химической промышленности, их используют в качестве катализаторов, в производстве керамики или в электротехнике. В свою очередь, понимание амфотерных свойств оксидов позволяет оптимизировать и контролировать реакции в различных областях химической промышленности.
Амфотерные оксиды
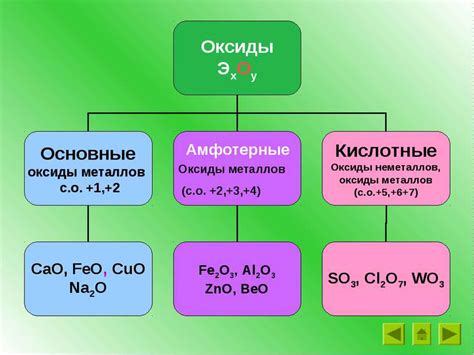
Амфотерными оксидами называются оксиды, которые могут проявлять как кислотные, так и основные свойства. Это означает, что при контакте с кислотой оксид может выступать в роли основания, а при контакте с основанием - в роли кислоты.
Одним из примеров амфотерных оксидов является оксид алюминия (Al2O3). При реакции с кислотой он образует соль и воду:
- Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Если же оксид алюминия взаимодействует с основанием, то образуется алюминат натрия и вода:
- Al2O3 + 2NaOH → 2NaAlO2 + H2O
Другим примером амфотерного оксида является оксид свинца (PbO). При реакции с кислотой он образует соль и воду:
- PbO + H2SO4 → PbSO4 + H2O
При взаимодействии оксида свинца с основанием образуется плумбат натрия и вода:
- PbO + 2NaOH → Na2PbO2 + H2O
Амфотерные оксиды являются важными в химической промышленности и используются, например, в процессе производства стекла, керамики и электроизоляторов. Изучение и использование этих соединений имеет большую практическую значимость в различных областях науки и техники.
Химические свойства

Амфотерный оксид с наименьшей положительной степенью окисления металла обладает рядом химических свойств, проявляющих его способность взаимодействовать как с кислотами, так и с щелочами.
Когда оксид с наименьшей положительной степенью окисления металла вступает в реакцию с кислотой, происходит образование соли и воды. При этом оксид выступает в роли основания, принимая протоны из кислоты и образуя гидроксокатион. Например, реакция оксида алюминия(III) с соляной кислотой приводит к образованию хлорида алюминия и воды:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Если же амфотерный оксид взаимодействует с щелочью, то происходит образование соли и воды, где оксид выступает в роли кислоты, отдавая свои протоны воде щелочи. Например, реакция оксида железа(II) с гидроксидом натрия приводит к образованию гидроксида железа(II) и воды:
FeO + 2NaOH → Fe(OH)2 + Na2O
Таким образом, амфотерные оксиды с наименьшей положительной степенью окисления металла проявляют свою способность взаимодействовать с кислотами и щелочами, что делает их важными для различных химических реакций и применения в различных областях науки и техники.
Реакция с кислотами

Амфотерный оксид с наименьшей положительной степенью окисления металла проявляет свои амфотерные свойства при взаимодействии с кислотами. В данной реакции оксид действует в качестве основания. Под действием кислоты оксид претерпевает химические изменения, происходит образование соли и воды.
Когда оксид вступает в реакцию с кислотой, формируется соль, при этом металл из оксида замещает водород в кислоте. Реакция между амфотерным оксидом и кислотой часто сопровождается образованием воды, которая обусловлена реакцией взаимного присоединения ионов гидроксида и водородного иона.
Например, реакция между оксидом алюминия (Al2O3) и серной кислотой (H2SO4) приводит к образованию соли серной кислоты - алюмосерной соли (Al2(SO4)3) и воды:
| Al2O3 | + | 3H2SO4 | = | Al2(SO4)3 | + | 3H2O |
Таким образом, амфотерный оксид с наименьшей положительной степенью окисления металла проявляет свои амфотерные свойства, вступая в реакцию с кислотами и образуя соли и воду. Это свидетельствует о его способности проявлять как кислотные, так и основные свойства в различных химических реакциях.
Реакция с основаниями

Амфотерные свойства оксида с наименьшей положительной степенью окисления металла проявляются и в его реакции с основаниями. Основания противопоставляются кислотам и обладают способностью принимать протоны, образуя анионы гидроксидов.
Реакция амфотерного оксида с основаниями может протекать по двум направлениям: либо оксид нейтрализует основание, образуя соль и воду, либо оксид образует соединение комплексного типа.
Во время нейтрализации оксид металла реагирует с гидроксидом металла, образуя соль в соответствии с реакцией:
- Металлический оксид + гидроксид → соль + вода
Например, оксидом алюминия можно воспользоваться для нейтрализации гидроксида натрия:
- Al2O3 + 6NaOH → 2Na3AlO3 + 3H2O
В случае образования соединения комплексного типа, амфотерный оксид образует с основанием структуру, называемую комплексным ионом. Такие ионы долго существуют только в растворе и оказываются продуктами реакции.
Примеры амфотерных оксидов

Амфотерные оксиды являются соединениями, которые могут проявлять как кислотные, так и основные свойства в зависимости от условий. Примеры амфотерных оксидов включают:
- Алюминиевый оксид (Al2O3): этот оксид реагирует как с кислотами, так и с основаниями. С кислотами образует соли, а с основаниями - алюминаты.
- Цинковый оксид (ZnO): этот оксид может реагировать как с кислотами, так и с основаниями. С кислотами образует соли, а с основаниями - цинкаты.
- Сурьмяный оксид (SnO): этот оксид обладает амфотерными свойствами и может реагировать как с кислотами, так и с основаниями, образуя соли.
- Свинцовый оксид (PbO): данный оксид также является амфотерным и может образовывать соли как с кислотами, так и с основаниями.
Это всего лишь некоторые примеры амфотерных оксидов. Существует множество других соединений, которые проявляют сходные свойства, что позволяет им взаимодействовать как с кислотами, так и с основаниями, в зависимости от условий окружающей среды.
Вопрос-ответ

Какие амфотерные свойства характерны для оксида с наименьшей положительной степенью окисления металла?
Оксид с наименьшей положительной степенью окисления металла обладает амфотерными свойствами, что означает, что он может реагировать и с кислотами, и с основаниями. Он может действовать как кислота, давая соли при взаимодействии с основаниями, а также как основание, реагируя с кислотами и образуя соли. Такие свойства проявляют, например, оксиды некоторых металлов, таких как алюминий, цинк и свинец.
Почему оксид с наименьшей положительной степенью окисления металла обладает амфотерными свойствами?
Оксиды с наименьшей положительной степенью окисления металла обладают амфотерными свойствами из-за наличия в их структуре свободных электронов, которые позволяют им реагировать как с кислотами, так и с основаниями. Когда оксид взаимодействует с основанием, свободные электроны передаются на атом металла, образуя ион металла с отрицательным зарядом. При реакции с кислотой, наоборот, атом металла осуществляет приём электронов, становясь положительно заряженным ионом. В результате образуется соль. Таким образом, амфотерные свойства оксида с наименьшей положительной степенью окисления металла обусловлены его способностью принимать или передавать электроны в реакциях с кислотами и основаниями.
Какие металлы образуют оксиды с наименьшей положительной степенью окисления и обладают амфотерными свойствами?
Оксиды с наименьшей положительной степенью окисления и амфотерными свойствами образуют некоторые металлы, такие как алюминий, цинк и свинец. Например, алюминиевый оксид (Al2O3) может реагировать как с кислотами, так и с основаниями. При взаимодействии с кислотами он образует соли с образованием ионов Аl3+, а при взаимодействии с основаниями образует соли с образованием ионов Аl(OH)4-. Такие свойства оксидов с наименьшей положительной степенью окисления металла позволяют им играть важную роль в реакциях окислительно-восстановительного типа и обладать широким спектром применений.
