Оксиды металлов занимают особое место среди различных химических соединений. Они обладают разнообразными свойствами и широко применяются в различных отраслях науки и промышленности. Особый интерес вызывают оксиды, которые взаимодействуют с водой.
Взаимодействие оксида металла с водой приводит к образованию растворимого основания, известного как щелочь. Щелочные растворы обладают щелочными свойствами и широко используются как химические реагенты. Растворимые основания относятся к классу соединений, которые могут образовывать ионы гидроксида в водном растворе. Эти ионы обладают выраженной щелочностью и способны образовывать щелочные растворы.
Процесс взаимодействия оксида металла с водой можно представить схематически. Молекулы оксида металла реагируют с молекулами воды, при этом образуются ионы гидроксида и ионы металла. Ионы гидроксида растворяются в воде, образуя щелочные растворы. Таким образом, оксид металла становится источником гидроксидных ионов, которые определяют щелочные свойства раствора.
Оксиды металлов: химические свойства и их взаимодействие с водой

Оксиды металлов - это химические соединения, образованные соединением металла с кислородом. Они широко распространены в природе и имеют разнообразные свойства и степень растворимости в воде.
Свойства оксидов металлов зависят от металла и его окислительности. Некоторые оксиды металлов могут быть также кислотными или амфотерными, то есть они могут взаимодействовать и с основаниями, и с кислотами.
Взаимодействие оксидов металлов с водой может вызывать различные реакции. Некоторые оксиды образуют сильные основания при растворении в воде, например оксид калия, натрия и бария. Эти основания реагируют с кислотами, образуя соли и воду.
Другие оксиды металлов, такие как оксиды железа или алюминия, образуют слабые кислоты при растворении в воде. Они могут реагировать с основаниями и образовывать соли.
Важным свойством оксидов металлов является их растворимость в воде. Некоторые оксиды легко растворяются, образуя растворимые основания, тогда как другие оксиды плохо растворяются или вообще не растворяются в воде.
Таким образом, оксиды металлов имеют различные свойства и взаимодействуют с водой по-разному, образуя основания или кислоты в зависимости от своей химической природы.
Растворимость оксидов металлов в воде и их классификация
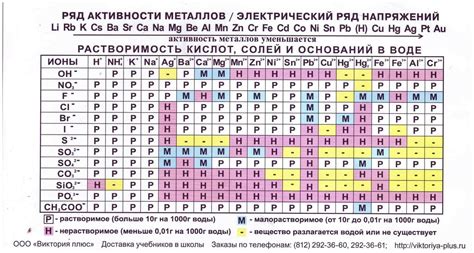
Оксиды металлов представляют собой химические соединения, состоящие из металлического элемента и кислорода. Взаимодействие оксидов металлов с водой приводит к образованию оснований, что делает их растворимыми в воде.
Растворимость оксидов металлов в воде зависит от ряда факторов, включая свойства металла, его окислительного состояния и степени окисления. Некоторые оксиды металлов растворяются в воде без образования основания, в то время как другие оксиды реагируют с водой, образуя растворимые основания.
Оксиды металлов можно классифицировать в зависимости от их растворимости в воде. Нерастворимые оксиды металлов, такие как оксиды магния (MgO) и алюминия (Al2O3), не реагируют с водой и не образуют оснований. Растворимые оксиды металлов, такие как оксиды натрия (Na2O) и калия (K2O), реагируют с водой, образуя щелочные растворы.
Важно отметить, что классификация оксидов металлов по их растворимости в воде не является абсолютной, и некоторые оксиды металлов могут проявлять свойства как нерастворимых, так и растворимых соединений в зависимости от условий. Например, оксид железа (Fe2O3) обычно считается нерастворимым в воде, однако в присутствии кислорода и воды он может растворяться и образовывать оксиды железа с более низкой степенью окисления, такие как Fe2O3·H2O (гидрооксид). Таким образом, растворимость оксидов металлов в воде является сложным и интересным аспектом изучения химии.
Процесс гидратации оксидов металлов и образование оснований

Одним из способов получения оснований является гидратация оксидов металлов. Гидратация - это процесс соединения оксидов металлов с молекулами воды, в результате которого образуются основания. Гидратация оксидов металлов происходит при контакте с природными водами или при специальном добавлении воды.
В результате гидратации оксидов металлов образуются гидроксиды - вещества, обладающие щелочными свойствами. Гидроксиды являются основаниями и способны образовывать растворы щелочей. Растворы гидроксидов металлов, такие как NaOH (натриевая щелочь) или KOH (калиевая щелочь), являются сильными основаниями и широко используются в промышленности и научно-исследовательских целях.
Процесс гидратации оксидов металлов является эндотермическим, то есть сопровождается поглощением тепла. При гидратации одного молекулы оксида металла требуется несколько молекул воды, так как одна молекула воды может донорствовать только один протон. Гидратация оксидов металлов происходит в несколько стадий, и окончательное образование основания зависит от условий процесса и свойств оксида металла.
Гидратация оксидов металлов играет важную роль в химической промышленности и в научных исследованиях. Гидроксиды, полученные путем гидратации оксидов металлов, используются в производстве широкого спектра продуктов, включая мыло, стекло, бумагу и многое другое. Понимание процесса гидратации оксидов металлов и образования оснований является важным для разработки новых материалов и технологий.
Ролевая функция оксидов металлов в реакциях органических соединений
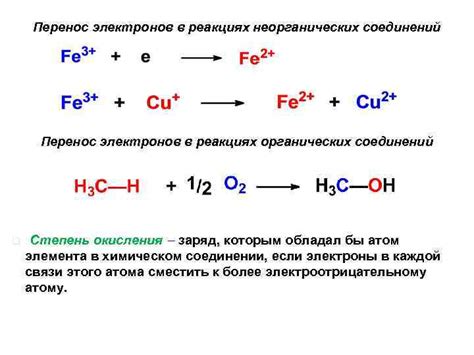
Оксиды металлов играют важную роль в реакциях органических соединений. Эти соединения представляют собой неорганические вещества, содержащие кислород и металлические ионы. Они обладают свойствами оснований и могут растворяться в воде, образуя щелочные растворы.
Способность оксидов металлов растворяться в воде и действовать как основания связана с их структурой. Оксиды металлов состоят из металлических и кислородных атомов, которые образуют кристаллическую решетку. Кислородные атомы имеют высокую электроотрицательность и образуют полярные межмолекулярные связи с водой.
Взаимодействие оксидов металлов с водой происходит по следующей схеме: оксид металла + вода → гидроксид металла. Гидроксид металла получается в результате реакции основания с водой и является прототипическим представителем щелочи.
Реакции оксидов металлов с органическими соединениями позволяют получать разнообразные продукты. Они могут служить катализаторами в различных химических превращениях и способствовать образованию новых соединений.
Таким образом, оксиды металлов играют важную роль в реакциях органических соединений, обладая способностью действовать как основания и катализаторы. Их взаимодействие с водой приводит к образованию гидроксидов металлов, которые являются щелочными растворами. Эти реакции представляют интерес для изучения и применения в различных областях химии и технологий.
Химические свойства оснований, образованных из оксидов металлов и воды

Оксиды металлов представляют собой химические соединения, состоящие из атомов металла и кислорода. При взаимодействии оксидов металлов с водой образуются основания - растворимые в воде соединения, обладающие щелочными свойствами.
Химические свойства оснований в значительной мере определяются свойствами оксида металла. Так, основания, образованные из щелочных металлов, например, натрия и калия, обладают высокой щелочностью и характеризуются высоким рН значениями. Они способны нейтрализовать кислоты и реагировать с кислотными оксидами, образуя соли и воду.
Основания, образованные из оксидов металлов переходных и пневматических групп, часто обладают амфотерными свойствами, то есть они могут проявлять и щелочные, и кислотные свойства. Такое поведение связано с возможностью образования комплексных соединений, а также с изменением степени окисления металла в реакции с водой.
Реакция оксидов металлов с водой является эндотермической и требует поступления энергии для ее протекания. В результате этой реакции образуется гидроксид металла и выделяется тепло. Гидроксид металла, в свою очередь, проявляет основные свойства и реагирует с кислотой или с кислотным оксидом, образуя соль и воду.
Таким образом, основания, образованные из оксидов металлов и воды, являются важными компонентами в химических процессах и находят широкое применение в различных отраслях промышленности и научных исследованиях.
Вопрос-ответ

Какие металлы образуют щелочные оксиды?
Щелочные оксиды образуют металлы группы 1 (натрий, калий, рубидий, цезий) и некоторые металлы группы 2 (кальций, стронций, барий).
Каким образом оксиды металлов взаимодействуют с водой?
Оксиды металлов реагируют с водой, образуя основания – гидроксиды этих металлов.
Что происходит при реакции оксидов металлов с водой?
При реакции оксидов металлов с водой оксид металла образует гидроксид, а из воды выделяется кислород.
Каково значение оксидов металлов в промышленности?
Оксиды металлов имеют большое значение в промышленности: они применяются в производстве стекла, керамики, электродов, катализаторов и других продуктов.
