Оксиды металлов - это класс химических соединений, состоящих из металлической и кислородной частей. Они представляют собой одни из самых распространенных химических соединений в природе и имеют широкий спектр применений в промышленности и научных исследованиях. Оксиды металлов могут быть как ионными, так и ковалентными соединениями, в зависимости от валентности металла и его способности образовывать связи с кислородом.
Примеры оксидов металлов включают оксид алюминия (Al2O3), оксид железа (Fe2O3), оксид кальция (CaO), оксид меди (Cu2O) и многие другие. Каждый из этих оксидов имеет свои уникальные свойства и применения. Например, оксид алюминия используется в производстве керамики, стекла и алюминиевой фольги, а оксид железа является основным компонентом ржавчины и используется в производстве красок и пигментов.
Химические свойства оксидов металлов включают их способность реагировать с другими веществами, образование солей и оксианидов при взаимодействии с кислотами и металлическими основаниями, а также их кислотность или щелочность. Оксиды металлов также могут быть использованы в качестве катализаторов реакций и для удаления загрязнений из газовых и жидких сред.
Взаимодействие оксидов металлов с другими веществами и их химические свойства делают их важным объектом изучения в области химии и материаловедения. Исследования свойств и применений оксидов металлов помогают разработать новые материалы и технологии, что способствует развитию науки и промышленности.
О свойствах и примерах оксида металла

Оксид металла представляет собой химическое соединение металла с кислородом. Он обладает рядом характеристических свойств, которые определяют его широкое применение в различных областях.
Одним из основных свойств оксидов металлов является их способность взаимодействовать с водой и образовывать основные растворы. Это связано с тем, что оксиды металлов имеют щелочные свойства, которые обусловлены высокой электроотрицательностью кислорода.
Примерами оксидов металлов являются оксид железа (Fe2O3), оксид алюминия (Al2O3), оксид магния (MgO) и многие другие. Отдельные оксиды, такие как оксид меди (CuO) и оксид свинца (PbO), также имеют широкое применение в промышленности и научных исследованиях.
Оксиды металлов часто используются в производстве керамики, стекла, электроники и катализаторов. Они обладают высокой тепло- и электропроводностью, что делает их полезными в различных технических и инженерных приложениях.
Помимо этого, оксиды металлов также используются в медицине, особенно в стоматологии, для создания материалов, используемых в качестве пломбировочных веществ и реставрационных материалов.
Что такое оксид металла
Оксид металла представляет собой химическое соединение, состоящее из металла и кислорода. Он образуется при реакции металла с кислородом воздуха или воды. Оксиды металлов широко распространены как в природе, так и используются в промышленности.
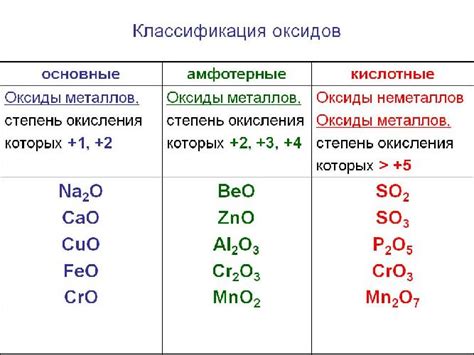
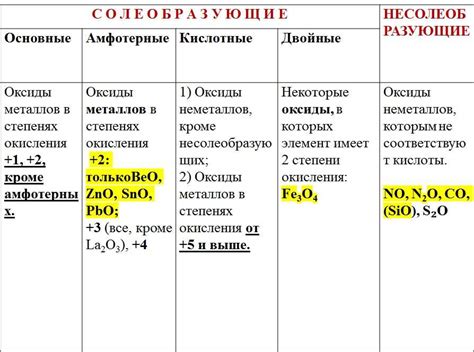
Оксиды металлов имеют различные физические и химические свойства в зависимости от металла, с которым они образуются. Некоторые оксиды металлов являются кислотными, другие - щелочными, а третьи - нейтральными.
Оксиды металлов широко используются в различных отраслях промышленности. Например, оксид железа (Fe2O3) применяется в производстве красок и косметики, а оксид алюминия (Al2O3) - в производстве абразивных материалов и керамики.
Благодаря своим свойствам оксиды металлов также находят применение в электротехнике, металлургии, строительстве и многих других областях. Изучение оксидов металлов позволяет расширить наши знания о химических свойствах и применении металлов в различных сферах деятельности.
Химические свойства оксида металла

Оксид металла - это химическое соединение металла с кислородом. Он отличается от металла своей химической активностью и способностью образовывать различные соединения.
Оксиды металлов проявляют ряд химических свойств, которые связаны с их структурой и взаимодействием с другими веществами. Они могут обладать кислотными или щелочными свойствами, что зависит от электрохимической активности металла.
Некоторые оксиды металлов образуют сильные щелочные растворы, которые могут реагировать с кислотами, образуя соли. Это позволяет оксидам металлов использоваться в промышленности для производства различных продуктов питания и химических соединений.
Также, оксиды металлов могут обладать катализирующими свойствами, то есть способностью ускорять химические реакции без участия в них. Это делает оксиды металлов важными компонентами катализаторов, которые активно применяются в различных промышленных процессах.
Важной химической особенностью оксидов металлов является их реакция с водой. Некоторые оксиды металлов реагируют с водой, образуя щелочные растворы, которые могут обладать амфотерными свойствами и изменять свою реакционную способность в зависимости от условий.
Оксиды металлов также могут образовывать различные химические соединения с другими веществами, например, с кислотами, солями, основаниями и другими металлами. Это свойство оксидов металлов позволяет им играть важную роль в химических реакциях, применяемых в промышленности и научных исследованиях.
В целом, химические свойства оксидов металлов определяются их структурой, электрохимической активностью и способностью взаимодействовать с другими веществами. Эти свойства делают оксиды металлов важными и широко используемыми соединениями в различных областях науки и промышленности.
Примеры оксидов металла

Оксиды металла – это химические соединения металлов с кислородом. Они обладают различными физическими и химическими свойствами и широко применяются в различных отраслях промышленности и науке.
Одним из наиболее известных примеров оксидов металла является оксид железа (Fe2O3), также известный как ржавчина. Он образуется при окислении железа воздухом или при высокой температуре. Оксид железа используется в производстве стали, красителей, магнитных материалов и многих других промышленных и научных целях.
Другим примером оксида металла является оксид алюминия (Al2O3), который широко используется в производстве керамики, стекла, абразивных материалов и алюминиевых сплавов. Оксид алюминия также имеет высокую термическую стабильность и используется в высокотемпературных приложениях, таких как изоляционные материалы и покрытия.
Оксид меди (CuO) – очень важное соединение меди, которое используется в качестве катализатора, красителя и в производстве электроники. Оксид меди также обладает полупроводниковыми свойствами и используется в солнечных батареях и других устройствах.
Другие примеры оксидов металла включают оксид цинка (ZnO), оксид свинца (PbO), оксид магния (MgO), оксид никеля (NiO) и многие другие. Каждый из этих оксидов имеет свои собственные свойства и применения в различных отраслях промышленности и науке.
Физические свойства оксида металла

1. Точка плавления и кипения: Оксиды металлов обладают высокой температурой плавления и кипения. Например, оксид железа имеет точку плавления около 1535 градусов Цельсия. Такая высокая температура связана с прочностью связей между металлическими и кислородными атомами в структуре оксида.
2. Фазовые переходы: Оксиды металлов могут претерпевать различные фазовые переходы в зависимости от условий окружающей среды, таких как температура и давление. За счет этих переходов оксиды металлов могут обладать различными свойствами, такими как проводимость электричества и тепла.
3. Цвет: Оксиды металлов могут иметь различные цвета, включая белый, серый, черный, красный и другие. Цвет оксида зависит от его химической формулы и структуры. Например, оксид меди (II), известный также как черная медь, имеет черный цвет, в то время как оксид цинка, известный как цинковая белила, имеет белый цвет.
4. Растворимость: Оксиды металлов обычно плохо растворяются в воде, но могут растворяться в кислотах или щелочах. Растворимость оксида зависит от его химической формулы и характера металлического элемента. Например, оксид алюминия нерастворим в воде, но растворяется в щелочах, образуя алюминаты.
5. Твердость: Оксиды металлов обычно являются твердыми веществами. Их твердость может быть различной в зависимости от структуры и элементов, входящих в состав оксида. Некоторые оксиды металлов такие, как оксид алюминия, обладают высокой твердостью и служат основой для производства шлифовальных и полировальных материалов.
Использование оксидов металла
Оксиды металла имеют широкое применение в различных отраслях промышленности и научных исследованиях. Некоторые из них используются в качестве катализаторов, другие - в процессах окрашивания и обработки поверхностей.
Одним из основных применений оксидов металла является их использование в производстве керамики и стекла. Оксиды металла добавляются в стекло для придания ему определенных свойств, таких как цвет, прозрачность или прочность. Оксиды железа, кобальта и хрома используются для придания керамике красивых оттенков и эстетического вида.
Оксиды металла также широко применяются в электронике и электротехнике. Например, оксид индия-олова (ITO) используется в производстве плоскопанельных дисплеев и солнечных батарей благодаря своей высокой проводимости и прозрачности для видимого света. Оксиды циркония и иттрия используются в качестве диэлектриков и пьезоэлектрических материалов.
Оксиды металла также имеют применение в качестве катализаторов в химической промышленности. Например, оксид молибдена используется в процессе гидроочистки нефти, а оксид ванадия – в производстве кислорода и серной кислоты. Катализаторы на основе оксидов металла ускоряют реакции, снижают энергозатраты и повышают эффективность производства.
Также нельзя не упомянуть использование оксидов металла в медицине. Например, оксид цинка используется в качестве антисептика и противовоспалительного средства, а оксид титана - в солнцезащитных средствах благодаря своей способности отражать ультрафиолетовые лучи. Оксиды металла также используются в дентистрии, для изготовления протезов и пломбировочных материалов.
Реакция оксида металла с другими веществами

Реакция оксида металла с водой является одной из самых распространенных и важных химических реакций. При взаимодействии оксида металла с водой образуется гидроксид металла. Например, оксид натрия (Na2O) реагирует с водой, образуя гидроксид натрия (NaOH). Эта реакция происходит с выделением тепла и образованием щелочной раствора.
Оксиды металлов также могут реагировать с кислотами, образуя соли и воду. В этом случае оксид металла действует как основание, а кислота - как кислота. Например, оксид меди (CuO) реагирует с соляной кислотой (HCl) и образует соль меди хлорид (CuCl2) и воду.
Оксиды металлов могут также реагировать с кислородом, образуя пероксиды или другие оксиды. Например, оксид марганца (MnO2) реагирует с кислородом и образует пероксид марганца (MnO2) или оксид марганца(IV) (MnO2).
Реакция оксида металла с аммиаком может привести к образованию сложных аммиачных соединений. Например, оксид меди (CuO) реагирует с аммиаком (NH3) и образует комплексное соединение меди аммиачное (Cu(NH3)42+).
В реакции оксида металла с хлоридом водорода может образоваться соль металла и вода. Например, оксид цинка (ZnO) реагирует с хлоридом водорода (HCl) и образует хлорид цинка (ZnCl2) и воду.
Вопрос-ответ

Какие вещества относятся к оксидам металлов?
Оксиды металлов – это химические соединения, состоящие из металла и кислорода. Примерами оксидов металлов являются оксид алюминия, оксид железа, оксид магния и др.
Какие свойства у оксидов металлов?
Оксиды металлов обладают различными свойствами в зависимости от конкретного соединения. Однако, в общем, оксиды металлов обладают высокой термической и химической стабильностью, являются проводниками электричества и имеют высокую температуру плавления.
Какие примеры оксидов металлов можно привести?
Примерами оксидов металлов являются оксид алюминия (Al2O3), оксид железа (Fe2O3), оксид магния (MgO), оксид кальция (CaO) и многие другие. Каждый из этих оксидов обладает своими уникальными свойствами и находит широкое применение в различных отраслях промышленности.
Каким образом оксиды металлов используются в повседневной жизни?
Оксиды металлов имеют широкое применение в повседневной жизни. Например, оксид алюминия используется в производстве керамики и стекла, оксид цинка – в косметической промышленности, а оксид железа – в производстве железобетона. Кроме того, оксиды металлов используются в производстве электроники, катализаторов и других отраслях промышленности.
