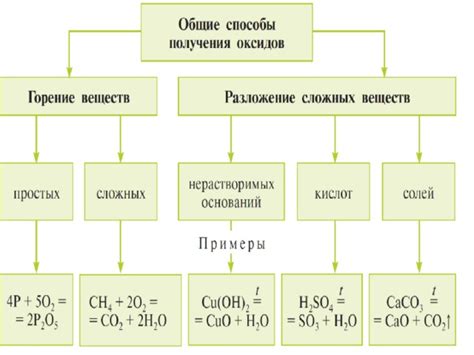
Оксид металла и кислота – это два основных компонента, которые участвуют в реакции обмена в химии. Реакция обмена, являющаяся одной из основных химических реакций, происходит между кислотой и оксидом металла. В результате этой реакции образуется соль и вода.
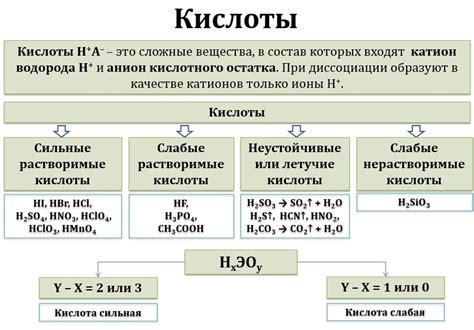
Кислоты являются одним из классов химических соединений, которые обладают кислотными свойствами. Они могут быть органическими или неорганическими. Кислоты имеют способность отдавать протоны (водородные ионы) и образовывать соли с основаниями. Кислоты могут быть сильными или слабыми в зависимости от своей концентрации.
Оксиды металлов, с другой стороны, являются неорганическими соединениями, состоящими из металлического и не-металлического элементов. Они обладают щелочными или амфотерными свойствами, так как они могут реагировать с кислотами и образовывать соли и воду. Оксиды металлов можно разделить на основные (щелочные) и амфотерные в зависимости от их реактивности.
В реакции обмена между оксидом металла и кислотой происходит перемена ионов: ионы металла из оксида металла и ионы водорода из кислоты образуют соль и воду. Эта реакция является обратимой и может быть использована в различных промышленных и лабораторных процессах. Реакция обмена между оксидом металла и кислотой является важным механизмом, который позволяет регулировать кислотно-щелочное равновесие в химических системах.
Оксиды металлов: химические соединения с кислотами
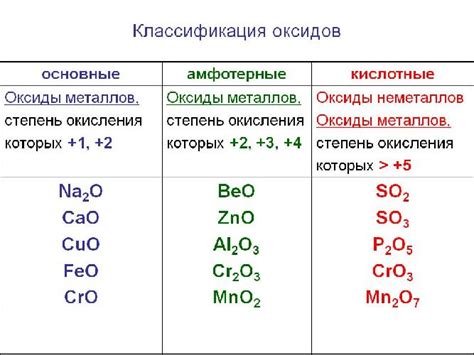
Оксиды металлов - это химические соединения, состоящие из металлического элемента и кислорода. В результате их реакции с кислотами образуется соль и вода. Эта реакция называется реакцией обмена или нейтрализацией.
Оксиды металлов играют важную роль в химии и находят широкое применение в различных отраслях промышленности. Они являются основными окислителями и обладают кислотными свойствами.
Взаимодействие оксидов металлов с кислотами происходит в соответствии с принципом сохранения массы и заряда. В результате этой реакции образуется соль, которая состоит из положительного ионa металла и отрицательного ионa кислоты, а также вода. Уравнение реакции обмена между оксидом металла и кислотой можно записать следующим образом:
| Оксид металла | + | Кислота | = | Соль | + | Вода |
| Na2O | + | HCl | = | NaCl | + | H2O |
| CaO | + | HNO3 | = | Ca(NO3)2 | + | H2O |
Оксиды металлов можно разделить на две группы: основные и амфотерные. Основные оксиды реагируют с кислотами, образуя соли и воду. Амфотерные оксиды, кроме реакции с кислотами, также могут реагировать с щелочами, образуя соответствующие соли и воду.
В заключение можно сказать, что оксиды металлов представляют собой важное класс химических соединений, которые обладают широким спектром свойств и применений. Их реакция с кислотами позволяет получить соли и воду, что имеет значительное значение в различных химических процессах.
Химические реакции, возникающие при взаимодействии оксидов металлов и кислот

В реакциях обмена оксидов металлов с кислотами происходит образование солей и воды. Данные реакции являются характерными для многих оксидов и кислот и имеют важное промышленное и химическое значение.
Химические реакции между оксидами металлов и кислотами происходят с образованием соединения воды и соли. Водой при этом является простая или одновременно две молекулы: Н2О или Н*, Н*О* Номенклатура оксидов металлов указывает, к какому элементу они относятся и какая степень окисления находится в них, что очень важно для дальнейшего изучения реакции.
Реакция водорода с кислотой может протекать с образованием или без образования газа. Безобразие происходит при взаимном контакте металла с кислородом и водородом в кислотеВторое сочетание происходит при взаимовоздействии двух газовых формин. Нергоцитет без очень не что с заключается концентрации соли. в рвадевраток. А газ и вода изменяются вместо протоков при взаимном контакте металла с серной кислотой образуя соль.
Примеры химических реакций: окисление железа в пыли сообразном оксиде железа и околпчании серы с образованием сульфата железа. В итоге реакции образуется вода и соль. Эти реакции широко используются в промышленности, например, при производстве железа и его сплавов.
Оксиды металлов и кислоты применяются в различных отраслях промышленности и в химической лаборатории для получения солей, а также для исследования их свойств и применения в различных сферах жизни.
Оксиды металлов: основные свойства и состав
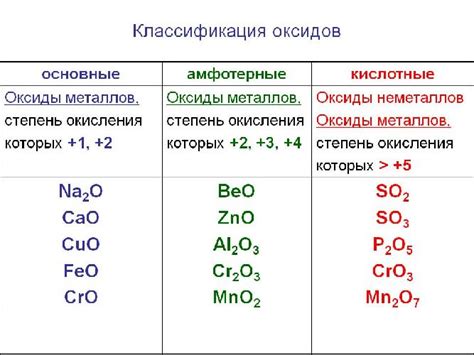
Оксиды металлов – это химические соединения, образующиеся в результате реакции между металлом и кислородом. Состав оксидов металлов может различаться в зависимости от конкретного металла и условий реакции.
Свойства оксидов металлов в значительной степени зависят от их состава. Вообще, оксиды металлов обладают высокой термической и электрической проводимостью, а также являются керамическими материалами с высокой твердостью.
Основные составы оксидов металлов:
- Бинарные оксиды – состоят из двух элементов: металла и кислорода. Примеры таких оксидов: оксид магния (MgO), оксид железа (Fe2O3), оксид цинка (ZnO).
- Многоокисные соединения – содержат в своем составе несколько форм металла с разными степенями окисления. Примеры включают оксид марганца (Mn2O7) и оксид хрома (CrO3).
- Смешанные оксиды – образуются при соединении двух или более различных металлов с кислородом. Примеры таких оксидов включают оксид меди и цинка (Cu2ZnSnO4) и оксид европия и церия (Eu2O3-CeO2).
Применение оксидов металлов:
- Оксиды металлов широко используются в металлургии для получения металлических элементов.
- Оксиды металлов являются важными катализаторами в различных химических реакциях.
- Некоторые оксиды металлов используются в производстве пигментов для красок и косметики.
- Оксиды металлов применяются в электронике и полупроводниковой промышленности для изготовления различных электронных компонентов.
- Некоторые оксиды металлов используются в качестве добавок к стеклу и керамике для придания им особых свойств.
Таким образом, оксиды металлов представляют собой важные химические соединения, которые находят применение в различных областях науки и техники. Их свойства и состав варьируются в зависимости от конкретного металла и условий реакции.
Кислоты: виды и их роль в химических реакциях
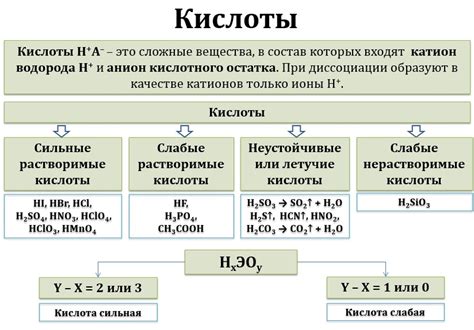
Кислоты – это химические соединения, которые могут выделять протоны (водородные ионы, H+) при реакции с основаниями. Они играют важную роль в химических реакциях, влияя на их характер и скорость.
В зависимости от содержания водорода, кислоты можно подразделить на различные виды. Например, органические кислоты содержат атомы углерода в своей молекуле, а примером такой кислоты является уксусная кислота (CH3COOH).
Также существуют неорганические кислоты, которые включают в себя растворимые в воде соединения. Одним из примеров неорганической кислоты является соляная кислота (HCl), которая образуется при процессе растворения хлористоводородного газа в воде.
В химических реакциях кислоты выступают как активные агенты. Они могут реагировать с металлами, образовывая соли и выделяя водород. Кроме того, кислоты могут реагировать с основаниями, образуя нейтральные соли и воду. Этот тип реакции называется реакцией нейтрализации.
Кислоты также используются в различных промышленных процессах, таких как производство удобрений, пищевая промышленность, фармацевтика и металлургия. Они играют важную роль в качестве катализаторов, регуляторов pH и очистителей.
Изучение свойств и реакций кислот является важным аспектом химии и позволяет углубленно понять основные принципы и законы химических превращений.
Способы получения оксидов металлов для реакций с кислотами
Оксиды металлов - это химические соединения, состоящие из кислорода и металлического элемента. Их можно получить различными способами, включая термическое разложение, нагревание соответствующих солей или химические реакции.
Один из способов получения оксидов металлов - термическое разложение соответствующих гидроксидов или карбонатов. Например, оксид железа (Fe2O3), который является основным компонентом краски "окиси железа", можно получить путем нагревания гидроксида железа (Fe(OH)3) или карбоната железа (FeCO3).
Другой способ получения оксидов металлов - нагревание неорганических солей металлов. Например, оксид меди (CuO) можно получить путем нагревания нитрата меди (Cu(NO3)2) или гидроксида меди (Cu(OH)2).
Также, оксиды металлов можно получить путем химических реакций, включая взаимодействие металлических порошков с кислотами. Например, оксид алюминия (Al2O3) можно получить путем реакции алюминия с кислотой серной (H2SO4).
Итак, существует несколько способов получения оксидов металлов для последующих реакций с кислотами. Эти способы включают термическое разложение, нагревание соответствующих солей и химические реакции. Каждый из них имеет свои особенности и применяется в зависимости от требуемого оксида металла.
Реакция оксида металла с кислотой: механизмы и стадии

Оксид металла и кислота – два основных компонента, которые вступают во взаимодействие при проведении реакции обмена в химии. Взаимодействие происходит в несколько стадий и сопровождается образованием соответствующих продуктов.
Первая стадия реакции – зона контакта оксида металла и кислоты. В этой зоне происходит диссоциация кислоты, при которой образуются положительные и отрицательные ионы. Затем происходит реакция между ионами кислоты и оксидом металла.
Механизм реакции зависит от химической природы оксида металла и кислоты. Если оксид металла является основанием, то он реагирует с кислотой, образуя соль и воду. При этом происходит перенос протона (H+) с кислоты на оксид металла.
Если же оксид металла является кислотным оксидом, то механизм реакции будет отличаться. В этом случае кислота реагирует с оксидом металла, образуя соль и воду. При этом происходит перенос протона с кислоты на оксид металла, и в реакции участвует также ион оксида.
Стадии реакции обмена между оксидом металла и кислотой включают в себя следующие шаги: 1) диссоциация кислоты, 2) взаимодействие ионов кислоты с оксидом металла, 3) образование соли и воды.
В результате реакции обмена между оксидом металла и кислотой происходит превращение исходных веществ в новые соединения. Знание механизмов и стадий этой реакции позволяет более точно понять процессы, происходящие в химической системе, и использовать их для различных целей, таких как синтез новых соединений или проведение анализа веществ.
Применение реакций оксидов металлов и кислот в промышленности
Реакции оксидов металлов и кислот являются одним из важных процессов в химической промышленности. Оксиды металлов - это химические соединения, содержащие кислород и металл, а кислоты - вещества, обладающие кислотными свойствами. В результате реакций оксидов металлов с кислотами образуются соли и вода.
Применение таких реакций находит широкое применение в производстве различных продуктов и материалов. Например, реакция оксида кальция с карбонатной кислотой приводит к образованию углекислого газа, который используется в производстве безалкогольных напитков, для газификации воды и других технологических процессах.
Реакции оксидов металлов и кислот также активно применяются в производстве удобрений. Здесь особенно важна реакция окиси азота с азотной кислотой. В результате реакции образуются азотные соединения, которые являются важными питательными элементами для растений. Такие удобрения позволяют повысить урожайность и качество сельскохозяйственной продукции.
Еще одной областью применения реакций оксидов металлов и кислот является производство металлов. Реакция оксида цинка с соляной кислотой, например, приводит к образованию хлорида цинка, который используется в гальваническом производстве, производстве лекарственных препаратов и других отраслях промышленности.
Также реакции оксидов металлов и кислот находят применение в очистке воды и сточных вод. Например, реакция оксида алюминия с серной кислотой приводит к образованию алюминийсульфата, который используется в процессе флокуляции для удаления твердых частиц и загрязнений из воды.
Все эти примеры демонстрируют важность и широкое применение реакций оксидов металлов и кислот в различных областях промышленности. Эти процессы играют ключевую роль в разработке новых технологий и повышении эффективности производства.
Вопрос-ответ

Какие реакции могут происходить между оксидами металлов и кислотами?
Между оксидами металлов и кислотами могут происходить реакции обмена, при которых образуются соли и вода.
Что происходит при реакции между оксидом металла и кислотой?
При реакции между оксидом металла и кислотой происходит образование соли и воды. Металлический оксид реагирует с кислотой, образуя соль, которая растворяется в воде, и вода также образуется в результате этой реакции.
Какие соли образуются при реакции обмена между оксидами металлов и кислотами?
При реакции обмена между оксидами металлов и кислотами образуются соли, состоящие из ионов металла и ионов кислоты. Например, при реакции между оксидом натрия и соляной кислотой образуется хлорид натрия (NaCl).
Каков механизм реакции обмена между оксидом металла и кислотой?
Механизм реакции обмена между оксидом металла и кислотой включает образование соли и воды. Сначала оксид металла реагирует с кислотой, образуя соль и воду. Затем соль растворяется в воде и образует ионы металла и ионы кислоты. Это позволяет соли и воде выполнять свои функции в реакции обмена.