Оксиды металлов являются важным классом химических соединений, которые выражают активность металлов в оксидной форме. Среди них особое место занимают оксиды металлов, обладающие кислотными свойствами и способные образовывать с сильными основаниями соли и воду. Одним из наиболее известных примеров такого типа соединений является оксид, образующий кислоту и соль Н2О.
Основным свойством оксида металла, образующего кислоту и соль Н2О, является его соединительная способность. Он образует кислоту, присоединяя к нему молекулярную воду (H2O), что позволяет образовываться кислоте солю. Это свойство является основой для применения оксида металла, образующего кислоту и соль Н2О, в различных областях науки и промышленности.
Применение оксида металла кислоты соли Н2О находит свое применение во многих областях. В медицине, кислота образует основу для лекарств, используемых в лечении различных заболеваний. В промышленности, оксид металла кислоты соли Н2О используется в процессах производства металлов, стекла и керамики. Кроме того, он также применяется в процессе очистки воды и водоснабжении.
Оксид металла: свойства и применение

Оксид металла - это химическое соединение, состоящее из металла и кислорода, где металл выступает в качестве катиона, а кислород - в качестве аниона. Они образуются в результате реакции окисления металла в присутствии кислорода или других окислителей.
Оксиды металлов обладают рядом уникальных свойств, которые определяют их широкое применение в различных отраслях промышленности и науки. Они обладают высокой термической и химической стабильностью, образуют кристаллическую структуру, способны проводить электрический ток и обладают разнообразными физическими и электронными свойствами.
Применение оксидов металлов широко распространено в качестве катализаторов, пигментов, проводников, абразивов и сырья для производства различных химических соединений. Они используются в производстве стекла, керамики, электроники, окрашивания материалов, аккумуляторов, магнитов и многих других продуктов.
Важно отметить, что различные оксиды металлов имеют разные свойства и применение. Например, оксид железа Fe2O3 используется в производстве красок и пигментов, оксид цинка ZnO - в производстве резины и косметики, а оксид алюминия Al2O3 - в производстве керамики и катализаторов.
Таким образом, оксиды металлов являются важными соединениями с уникальными свойствами, которые находят широкое применение в различных сферах человеческой деятельности. Их разнообразные свойства и возможности позволяют использовать оксиды металлов в различных технологических процессах и создавать инновационные продукты.
Металлический оксид как кислота: основные характеристики
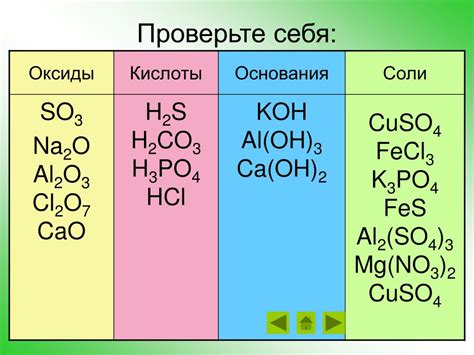
Металлический оксид - это химическое соединение между металлом и кислородом. Важной особенностью оксида металла является его способность действовать как кислота, то есть обладать кислотными свойствами. Это означает, что оксид металла может реагировать с щелочью или основанием, образуя соль и воду.
Когда оксид металла реагирует с щелочью, образуется соль и вода. Например, оксид цинка (ZnO) реагирует с гидроксидом натрия (NaOH) и образует соль цинката натрия (Na2ZnO2) и воду. Этот процесс называется нейтрализацией и является основным свойством кислотного поведения оксидов металлов.
Оксиды металлов также могут реагировать с кислотами, образуя соль и воду. Например, оксид железа (Fe2O3) реагирует с соляной кислотой (HCl) и образует соль хлорида железа (FeCl3) и воду. Эта реакция также является примером кислотного поведения оксидов металлов.
Оксиды металлов, действующие как кислоты, имеют ряд важных применений. Например, они используются в производстве стекла, керамики и электроники. Оксиды металлов также широко применяются в катализаторах, а также в производстве аккумуляторов и пигментов для красок.
Оксид металла как соль: структура и свойства
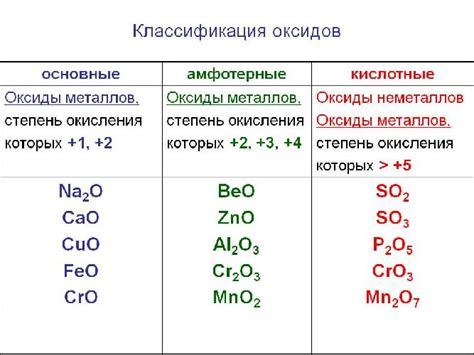
Оксид металла представляет собой химическое соединение, в котором кислород связан с металлом. В результате образования связи между металлом и кислородом, оксид металла приобретает свойства соли.
Структура оксида металла может быть различной, в зависимости от конкретного соединения. Оксиды металлов могут иметь кристаллическую структуру, аморфную структуру или быть представлены в виде полимеров. Однако, независимо от структуры, оксиды металлов обладают общими свойствами солей.
Оксиды металлов, как и другие соли, обычно обладают высокой температурой плавления и кипения, что объясняется сильными химическими связями между атомами металла и кислорода. Кроме того, оксиды металлов обладают хорошей электропроводностью как в твердом, так и в расплавленном состоянии.
Среди основных свойств оксидов металлов можно выделить их кислотность или щелочность. Некоторые оксиды металлов растворяются в воде, образуя щелочные растворы, которые могут быть использованы в качестве жидких удобрений или в процессе нейтрализации кислот.
Используя свойства оксидов металлов как солей, можно получить широкий спектр применений. Они могут быть использованы в производстве керамики, стекла, электронных компонентов, катализаторов и других химических веществ. Кроме того, оксиды металлов находят применение в медицине, сельском хозяйстве и производстве пищевых добавок.
Реакция оксида металла с водой: особенности и применение

Оксид металла – это соединение металла с кислородом. При контакте оксида металла с водой происходит реакция, которая может иметь различный характер в зависимости от свойств металла и его оксида.
Одна из особенностей реакции оксида металла с водой заключается в образовании кислоты. В результате реакции оксид металла взаимодействует с водой, образуя кислородные ангидриды и кислоты. Например, оксид алюминия взаимодействует с водой, образуя кислоту алюминия – H3AlO3. Таким образом, реакция оксида металла с водой может приводить к образованию солей и кислот.
Реакция оксида металла с водой имеет широкое применение в различных областях. Например, она используется в химической промышленности для получения различных соединений на основе металлов. Также реакция оксида металла с водой может быть использована для очистки воды от загрязнений. В процессе реакции оксид металла с водой происходит окисление вредных примесей, что позволяет удалить их из воды.
Особенностью реакции оксида металла с водой является образование гидроксидов. Гидроксиды металлов широко применяются в различных отраслях промышленности, таких как производство керамики, стекла, электроники и других. Гидроксиды металлов также используются в медицине, косметологии и сельском хозяйстве.
Кислотные и основные свойства оксида металла
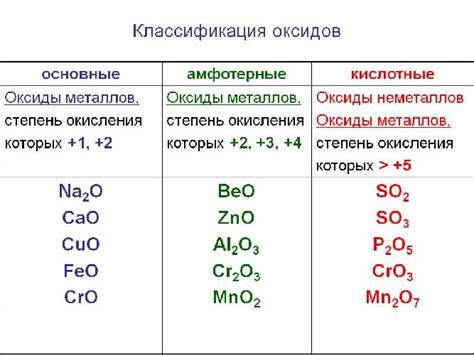
Оксид металла является химическим соединением, состоящим из металла и кислорода. Это вещество может проявлять как кислотные, так и основные свойства, в зависимости от реагентов, с которыми оно взаимодействует.
Кислотные свойства оксида металла проявляются при контакте с водой или кислотами. В результате такой реакции оксид металла образует кислоту. Например, оксид серы взаимодействует с водой и образует серную кислоту:
- Сернистый оксид (SO2) + вода (H2O) → серная кислота (H2SO3)
Основные свойства оксида металла проявляются при реакции с щелочами или основаниями. В результате такой реакции оксид металла образует соль и воду. Например, оксид кальция реагирует с гидроксидом натрия и образует соль натрия и воду:
- Оксид кальция (CaO) + гидроксид натрия (NaOH) → соль натрия (Na2O) и вода (H2O)
Таким образом, оксиды металлов могут проявлять как кислотные, так и основные свойства в химических реакциях с различными реагентами. Это делает их важными компонентами для получения кислот и солей, а также для многих других применений в химической промышленности и научных исследованиях.
Применение оксида металла в промышленности и быту

Оксид металла – это химическое соединение, состоящее из металла и кислорода. Из-за своих уникальных свойств, оксиды металлов широко применяются в различных отраслях промышленности и быту.
Промышленное применение:
- Производство стальных и других металлических сплавов – оксиды металлов используются как сырье для производства различных металлических материалов. Например, оксид железа используется при производстве стали.
- Производство красок и пигментов – некоторые оксиды металлов обладают яркими цветами и используются в производстве красок и пигментов для различных отраслей промышленности, включая строительство и автомобильную промышленность.
- Катализаторы – оксиды металлов часто используются в качестве катализаторов для ускорения химических реакций в промышленности. Например, оксид цинка используется в производстве синтетического каучука.
- Электроника – оксиды металлов используются в производстве электронных компонентов, таких как транзисторы и конденсаторы. Оксиды металлов обладают полупроводниковыми свойствами, что позволяет им использоваться в электронике.
Применение в быту:
- Строительство – оксиды металлов используются для производства строительных материалов, таких как цемент и кирпичи. Например, оксид кальция применяется при производстве цемента.
- Косметика – некоторые оксиды металлов используются в косметических продуктах, таких как кремы и губная помада. Они придают продуктам цвет и текстуру.
- Пищевая промышленность – оксиды металлов используются в пищевой промышленности в качестве красителей и консервантов. Например, оксид железа используется для окрашивания пищевых продуктов.
В заключение, оксиды металлов широко используются как в промышленности, так и в быту. Они играют важную роль в производстве различных материалов и продуктов, обладая при этом уникальными свойствами, которые делают их незаменимыми во многих сферах деятельности.
Вопрос-ответ

Какие свойства имеет оксид металла?
Оксид металла - это химическое соединение, образованное металлом и кислородом. У оксидов металлов есть несколько общих свойств: они обладают высокой тепло- и электропроводностью, имеют кристаллическую структуру, часто являются твердыми веществами с высокими температурами плавления и кипения. Кроме того, многие оксиды металлов обладают кислотными или щелочными свойствами.
Что такое оксид металла кислота соль Н2О?
Оксид металла кислота соль Н2О - это химическое соединение, состоящее из оксида металла, кислоты и воды. Это трехкомпонентная система, в которой металлический оксид образует соль с кислотой, при этом образуется вода. Это соединение имеет свои уникальные свойства и применения в различных областях науки и промышленности.
Какие свойства имеет оксид металла кислота соль Н2О?
Оксид металла кислота соль Н2О обладает рядом уникальных свойств. Во-первых, оно обычно образуется при нейтрализации кислоты оксидом металла, что позволяет использовать его в качестве средства для регулирования pH. Кроме того, это соединение может быть использовано как катализатор в различных химических реакциях. Оксид металла кислота соль Н2О также может быть электролитом, что позволяет использовать его в электрохимических процессах.
В каких областях применяют оксид металла кислота соль Н2О?
Оксид металла кислота соль Н2О находит свое применение в различных областях науки и промышленности. Он используется в качестве катализатора в химических реакциях, например, в производстве аминаций и гидрировании органических соединений. Это соединение также может быть использовано в качестве средства для регулирования pH в различных процессах, в том числе в производстве пищевых продуктов и фармацевтических препаратов. Кроме того, оксид металла кислота соль Н2О может быть использован как электролит в различных электрохимических процессах.
