Расчет эквивалента металла по израсходованному оксиду металла и водороду является одной из важных задач в химии. Этот метод позволяет определить количество металла, содержащегося в оксиде, по количеству образовавшегося водорода и израсходованному оксиду.
Процесс расчета эквивалента металла основывается на знании реакции между металлом и кислородом. При нагревании оксида металла с водородом происходит реакция, в результате которой образуется вода и металл выходит в свободное состояние. Известно, что металл полностью реагирует с кислородом в оксиде, следовательно, эквивалент металла равен эквиваленту оксида.
Расчет эквивалента металла можно произвести с использованием простого химического уравнения, в котором указывается соотношение между оксидом металла и водородом. Из этого уравнения можно получить коэффициент эквивалента металла, который указывает на to количество граммов металла, содержащихся в 1 моль эквивалента оксида. Данный коэффициент можно использовать для расчета эквивалента металла в других экспериментах или процессах.
Оксид металла и водород

Оксид металла - это химическое соединение, состоящее из металла и кислорода. Присутствие кислорода придает оксидам металлов различные свойства и имеет большое значение в металлургической и химической промышленности. Некоторые оксиды металлов широко используются в производстве стекла, керамики, эмали, а также в процессах окисления и восстановления металлов.
Водород - это химический элемент, наиболее легкий из всех известных элементов. Водород обладает химической активностью и может образовывать соединения с многими другими элементами. Он является одним из основных компонентов воды и является важным источником энергии во многих процессах, таких как синтез аммиака или производство водородной энергии.
Оксид металла и водород могут участвовать в различных химических реакциях и образовывать новые соединения. Одной из важных реакций является восстановление оксида металла при помощи водорода. В результате реакции образуется металл и вода. Эта реакция широко используется в металлургической промышленности для получения металлов из оксидов.
Обратная реакция, при которой металл окисляется и образуется оксид металла, также возможна. Такие реакции могут протекать как в присутствии водорода, так и без него. Во многих случаях, например, в электролизе, водород играет роль восстановителя и предотвращает образование оксида металла.
Масса оксида металла и водорода, участвующих в реакции, позволяет рассчитать эквивалент металла по их количеству. Этот расчет имеет важное значение в различных химических процессах и позволяет определить степень окисления металла или его концентрацию в реакционной смеси.
Расчет эквивалента металла
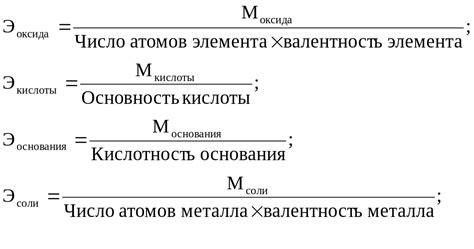
Расчет эквивалента металла осуществляется с помощью формул, которые учитывают количество израсходованного оксида металла и образовавшегося водорода.
Для расчета эквивалента металла используется стехиометрическое соотношение между оксидом металла и водородом при соответствующей реакции. Например, для реакции образования оксида металла по формуле:
M + H2O -> MO + H2
где М обозначает металл, MO - оксид металла, H2O - вода, H2 - образующийся водород, известно стехиометрическое соотношение, которое гласит, что одна молекула оксида металла соответствует одной молекуле водорода.
Используя известное количество израсходованного оксида металла и образовавшегося водорода, можно определить количество металла, эквивалентное данному количеству оксида. Для этого необходимо выразить количество металла через количество оксида в соответствии с соотношением, установленным для данной реакции.
Данный расчет позволяет определить эквивалентное количество металла по израсходованному оксиду и водороду, что полезно при проведении аналитических исследований и контроле качества металлов.
Израсходованный оксид металла
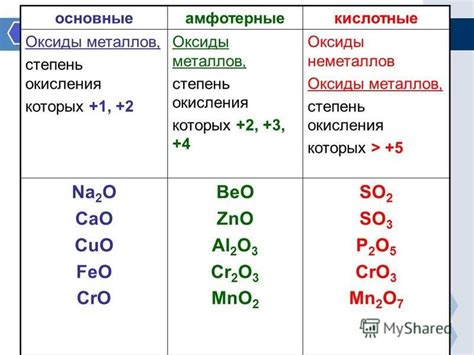
Израсходованный оксид металла представляет собой соединение, которое образуется в процессе окисления металла в присутствии кислорода. Оксид металла имеет важное значение в химической промышленности, так как используется в качестве сырья для получения металла.
При израсходовании оксида металла образуется не только металл, но и другие продукты, такие как водород. Эти продукты могут быть использованы для расчета эквивалента металла, который позволяет определить количество металла, полученного из исходного оксида металла. Расчет эквивалента металла является важной задачей в химической промышленности.
Существует несколько способов расчета эквивалента металла по израсходованному оксиду металла и водороду. Один из них основан на уравнении реакции, в котором оксид металла превращается в металл в присутствии водорода. Другой способ основан на измерении количества образовавшегося металла. Также существуют методы гравиметрического анализа, определяющие содержание металла в полученном продукте.
Израсходованный оксид металла имеет широкое применение в различных отраслях промышленности, включая металлургию, электронику, строительство и другие. Оксид металла является важным промежуточным продуктом, который после дополнительной обработки может быть использован в производстве различных материалов и изделий.
Израсходованный водород
Израсходованный водород – это водород, потребляемый или исчезающий в результате химических реакций. При проведении различных процессов, водород может быть использован для получения энергии, синтеза различных соединений или использоваться как реагент.
Израсходованный водород может возникать в различных отраслях промышленности, таких как производство химических веществ, нефтепереработка, производство электричества и др. Также водород можно использовать в процессе открытых условиях или в реакторах с контролируемой атмосферой.
Исчезновение водорода в результате реакций может быть либо временным, когда он используется в качестве реагента и все его атомы входят в новые связи, либо окончательным, когда он полностью расходуется и не может быть восстановлен или использован повторно.
Обратимся к примеру процесса электролиза воды. При проведении этого процесса, водород выделяется на одном из электродов, а оксиген – на другом. В результате этой реакции, водород расходуется и его количество уменьшается. Таким образом, израсходованный водород можно использовать для расчета объема взаимодействия между веществами или для определения эффективности проведенного процесса.
Вопрос-ответ

Какой метод используется для расчета эквивалента металла по израсходованному оксиду металла и водороду?
Для расчета эквивалента металла по израсходованному оксиду металла и водороду широко применяется метод гравиметрии или метод отбора и анализа проб на содержание металла.
Какие факторы могут повлиять на результаты расчета эквивалента металла?
Результаты расчета эквивалента металла могут быть зависимыми от таких факторов, как чистота исходного оксида металла, точность измерений массы оксида и объема образовавшегося водорода, а также возможная потеря металла в процессе его осаждения.
