Реакция оксида металла с неметаллом - один из фундаментальных процессов в химии. Она имеет огромное значение в промышленности, науке и повседневной жизни. Оксиды металлов - это химические соединения, состоящие из металла и кислорода. Неметаллы же - это элементы, которые не обладают металлическими свойствами. Взаимодействие оксида металла с неметаллом приводит к образованию нового вещества - соли.
Особенностью реакции оксида металла с неметаллом является возможность образования различных типов солей в зависимости от комбинации металла и неметалла. Например, при взаимодействии кислорода с металлом натрия образуется хлорид натрия, а при взаимодействии кислорода с металлом алюминия образуется оксид алюминия.
Примером такой реакции может служить реакция оксида железа с углеродом, при которой образуется соль - железный карбид. Данное соединение используется в металлургии для производства стали с помощью метода доменной плавки.
Важно отметить, что реакция оксида металла с неметаллом обычно сопровождается выделением энергии в виде тепла или света, что является еще одной особенностью этого процесса. Это объясняется реакцией окисления-восстановления, при которой происходит передача электронов от металла к неметаллу.
Оксиды и их свойства
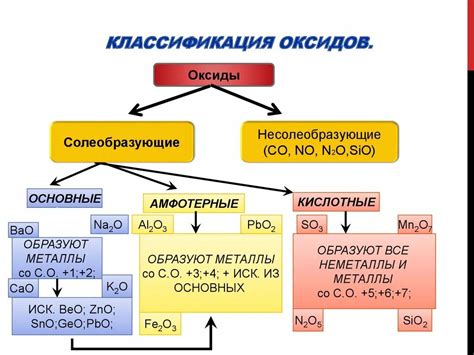
Оксиды – это соединения элементов с кислородом. Они обладают различными свойствами, зависящими от природы металла или неметалла, с которым связан кислород.
Оксиды металлов обычно обладают щелочными свойствами, так как металлы обычно образуют щелочные оксиды. Они растворяются в воде, образуя щелочные растворы или гидроксиды. Некоторые щелочные оксиды, такие как CaO (известь) и MgO (доломит), широко используются в строительстве.
Оксиды неметаллов, напротив, обычно обладают кислотными свойствами и реагируют с водой, образуя кислотные растворы. Например, оксид серы (SO2) смешивается с водой и образует серную кислоту (H2SO3), который широко применяется в химической промышленности и производстве удобрений.
Кроме того, некоторые оксиды обладают амфотерными свойствами и могут проявлять как кислотные, так и щелочные свойства в зависимости от условий реакции. Например, оксид алюминия (Al2O3) может реагировать как с щелочами, так и с кислотами, образуя соответствующие соли.
Таким образом, оксиды играют важную роль в химических реакциях и имеют разнообразные применения в различных отраслях промышленности и научных исследованиях.
Принцип реакции оксида металла с неметаллом

Взаимодействие оксида металла с неметаллом является основой таких химических реакций, как окисление и горение. При этом происходит перемещение электронов от металла к неметаллу, что приводит к образованию новых химических связей.
Реакция оксида металла с неметаллом может происходить с образованием соли или кислоты. В данном случае оксид металла действует в качестве основы, а неметалл - в качестве кислоты. Такая реакция может быть представлена следующим образом:
- Металлический оксид + неметалл → соль
- Металлический оксид + неметалл + вода → кислота
Например, взаимодействие оксида кальция (CaO) с углекислым газом (CO2) приводит к образованию карбоната кальция (CaCO3).
Также, реакция оксида серы (SO2) с водой (H2O) приводит к образованию сульфитной кислоты (H2SO3).
Таким образом, принцип реакции оксида металла с неметаллом заключается в образовании новых химических связей и образовании солей или кислот.
Химические свойства оксидов металлов и их влияние на реакцию

Оксиды металлов представляют собой химические соединения, в состав которых входит кислород и один или несколько металлических элементов. Такие соединения обладают рядом свойств, которые влияют на их реакционную способность и поведение при взаимодействии с неметаллами.
Одним из основных свойств оксидов металлов является их основность. Взаимодействуя с водой, оксиды металлов образуют щелочные растворы, в которых ионизируются, образуя гидроксиды металлов. Например, оксид натрия взаимодействует с водой, образуя гидроксид натрия и выделяя тепло:
- Na2O + H2O → 2NaOH
Кроме того, оксиды металлов способны взаимодействовать с кислородом, образуя соединения перекисей металлов. Например, оксид меди взаимодействует с кислородом, образуя перекись меди:
- 2CuO + O2 → 2CuO2
Также оксиды металлов проявляют кислотные свойства в реакциях с щелочами и основаниями. Например, оксид алюминия и гидроксид натрия взаимодействуют, образуя натрий-алюминиевую соль:
- Al2O3 + 6NaOH → 2Na3AlO3 + 3H2O
Таким образом, химические свойства оксидов металлов определяют их активность и способность вступать во взаимодействие с неметаллами, кислотами, основаниями и другими соединениями, что является важным фактором при процессах синтеза и применении оксидов металлов в различных областях науки и промышленности.
Примеры реакций оксида металла с неметаллом:

1. Реакция оксида кальция (CaO) с водой (H2O)
При взаимодействии оксида кальция с водой происходит образование гидроксида кальция (Ca(OH)2). Эта реакция является экзотермической, то есть сопровождается выделением тепла. Образовавшийся гидроксид кальция обладает щелочными свойствами.
- CaO + H2O → Ca(OH)2
2. Реакция оксида железа (Fe2O3) с углеродом (C)
При нагревании оксида железа с углеродом образуется железо и углекислый газ. Эта реакция носит название восстановления и является редукционной реакцией.
- 2Fe2O3 + 3C → 4Fe + 3CO2
3. Реакция оксида серы (SO3) с водой (H2O)
При прямом взаимодействии оксида серы с водой образуется серная кислота (H2SO4). Это одна из ключевых реакций при получении серной кислоты в промышленности.
- SO3 + H2O → H2SO4
4. Реакция оксида азота (NO2) с водой (H2O)
При контакте оксида азота с водой происходит образование азотной кислоты (HNO3), более известной как азотная кислота или азотная вода.
- 3NO2 + H2O → 2HNO3 + NO
Образование кислот в результате реакции

Реакция оксида металла с неметаллом может привести к образованию различных кислот.
Один из примеров такой реакции - взаимодействие оксида серы (IV) с водой. В результате этой реакции образуется сульфатная кислота:
SO2 + H2O → H2SO4
Другим примером такой реакции является сочетание оксида азота (V) с водой. В результате образуется азотная кислота:
NO2 + H2O → HNO3
Кроме того, реакция оксида фосфора (V) с водой приводит к образованию фосфорной кислоты:
P2O5 + 3H2O → 2H3PO4
Такие реакции могут иметь важное промышленное значение, поскольку полученные кислоты широко используются в различных отраслях, включая производство удобрений, пищевой промышленности и фармацевтику. Также они могут быть использованы в экспериментах и для получения других химических соединений.
Взаимодействие оксидов металлов с ионами неметаллов
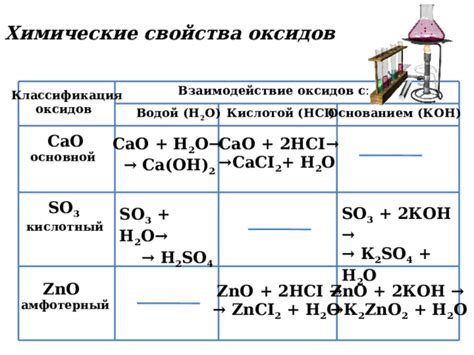
Оксиды металлов представляют собой соединения, состоящие из металлического и кислородного атомов. При взаимодействии с ионами неметаллов оксиды металлов могут проявлять различные свойства и образовывать разнообразные соединения.
В некоторых случаях оксиды металлов могут реагировать с ионами неметаллов, образуя кислоты. Например, оксид металла кальция (CaO) при взаимодействии с водой образует гидроксид кальция (Ca(OH)2), который является щелочью. Также оксид металла алюминия (Al2O3) может реагировать с кислородом, образуя алгид пероксида алюминия (AlO(O2)2).
Оксиды металлов также могут реагировать с ионами неметаллов, образуя соли. Например, оксид металла натрия (Na2O) при взаимодействии с ионами хлора (Cl-) образует соль натрия и хлора (NaCl). Также оксид металла магния (MgO) может реагировать с ионами серы (S2-), образуя соль магния и серы (MgS).
На величину реакции оксидов металлов с ионами неметаллов может влиять степень окисления металла. Например, оксид металла железа (III) (Fe2O3) при взаимодействии с ионами хлора образует хлорид железа (III) (FeCl3), где железо имеет степень окисления +3. Возможно также образование более сложных соединений, например, оксид металла меди (I) (Cu2O) при взаимодействии с ионами серы образует соль меди (I) и серы (Cu2S), где медь имеет степень окисления +1.
Значение реакции оксида металла с неметаллом в промышленности и повседневной жизни

Реакция оксида металла с неметаллом имеет огромное значение в промышленности и повседневной жизни, так как она позволяет получать различные продукты, необходимые для производства и удовлетворения потребностей общества. Эта реакция является основой для производства множества веществ и материалов.
В промышленности реакция оксида металла с неметаллом используется для получения различных сплавов, соединений и материалов. Например, реакцией оксида алюминия с неметаллом кремнием получают алюмосиликаты, которые используются в производстве стекла, керамики и огнеупорных материалов. Также реакция оксида железа с неметаллом кислородом позволяет получать железные оксиды, которые используются для производства красок, косметики и строительных материалов.
В повседневной жизни реакция оксида металла с неметаллом также находит широкое применение. Например, реакцией оксида алюминия с неметаллом кислородом получают алюминий, который используется для производства автомобилей, самолетов, электропроводов и других изделий. Реакция оксида углерода с неметаллом водородом позволяет получать природный газ, который используется в быту для отопления и приготовления пищи.
Также реакция оксида металла с неметаллом имеет значение для энергетики. Например, реакция оксида меди с неметаллом серой позволяет получать медные сульфиды, которые используются в производстве аккумуляторов и солнечных панелей. Эта реакция также применяется в процессах выработки электроэнергии и хранения энергии.
Вопрос-ответ

Что такое реакция оксида металла с неметаллом?
Реакция оксида металла с неметаллом - это химическая реакция, в результате которой оксид металла и оксид неметалла соединяются, образуя химическое соединение.
Какие особенности имеет реакция оксида металла с неметаллом?
Одной из особенностей реакции оксида металла с неметаллом является образование химического соединения, в результате которого может происходить образование ионных связей. Кроме того, реакция может сопровождаться выделением тепла и света, изменением физических свойств вещества и другими химическими изменениями.
Какие примеры можно привести реакции оксида металла с неметаллом?
Примеры реакций оксида металла с неметаллом включают реакцию оксида меди (II) с серой, в результате которой образуется сульфид меди (II): CuO + S → CuS; реакцию оксида железа (III) с фосфором, образующей фосфид железа (III): Fe2O3 + P → 2FeP; и реакцию оксида кальция с кислородом, в результате которой образуется оксид кальция: CaO + O2 → CaO2.
