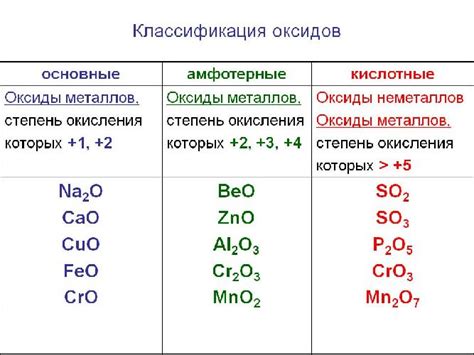
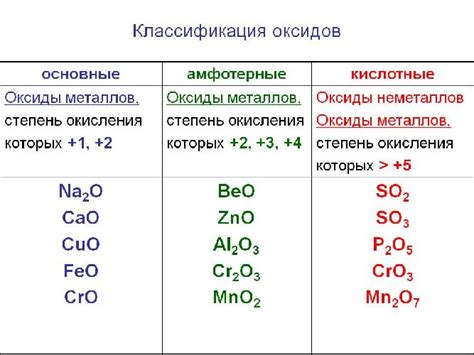
Оксиды металлов - это химические соединения, образуемые при взаимодействии металлов с кислородом. Широкое применение оксидов металлов в различных отраслях промышленности связано с их электрохимическими свойствами. Вопрос о том, являются ли оксиды металлов электролитами или не электролитами, вызывает интерес ученых и специалистов в области химии.
Электролиты - это вещества, которые в растворе или плавятся состоянии разлагаются на ионы и обладают проводимостью электрического тока. Зависит ли проводимость оксидов металлов от их структуры и типа связи в молекуле? Некоторые оксиды металлов, например оксиды неметаллов, как диоксид углерода, не обладают ионными свойствами и не являются электролитами. Однако, существуют и оксиды металлов, образующие электролиты, такие как оксиды щелочных и щелочноземельных металлов.
Важность раскрытия механизмов проводимости оксидов металлов заключается в их применении в разных областях, включая технологии энергосбережения и электрохимическую промышленность. Исследования в этой области позволяют получить новые знания об электрохимических свойствах оксидов металлов и задействовать их в разработке технологий с высокой эффективностью.
Оксид металла и его электролитические свойства
Оксид металла – это химическое соединение, состоящее из металла и кислорода. В зависимости от свойств металла и степени окисления, оксиды могут обладать электролитическими свойствами или быть непроводниками электричества.
Для определения электролитических свойств оксида металла необходимо изучить его растворимость в воде. Если оксид металла растворяется в воде, то его раствор будет проводить электрический ток и называться электролитом. Это связано с образованием ионов металла и кислорода в растворе. Ионы металла с положительным зарядом будут двигаться к катоду, а ионы кислорода с отрицательным зарядом – к аноду.
Однако, некоторые оксиды металлов не растворяются в воде и не обладают электролитическими свойствами. Такие оксиды называются непроводниками. Это связано с тем, что ионы металла и кислорода в непроводящих оксидах не могут двигаться ионным образом, так как они остаются связанными в кристаллической решетке.
Электролитические свойства оксида металла могут быть полезными для различных практических применений. Например, электролитическое вещество может использоваться в электролитическом гальваническом элементе или в электролизере для получения чистого металла. Непроводниковые оксиды металла также имеют свои применения, например, в качестве изоляционных материалов или как защитные покрытия для металлических поверхностей.
Что такое оксид металла?
Оксид металла – это химическое соединение, состоящее из металлического катиона и кислородного аниона. Оксиды металлов обладают широким спектром свойств и применяются в различных отраслях науки и промышленности.
Оксиды металлов обычно имеют электроотрицательность меньшую, чем у кислорода. Из-за этого они обладают ионными связями, где металл передает электроны кислороду. Это делает оксиды металлов стабильными соединениями, которые обычно представлены в виде кристаллических твердых веществ.
Важной особенностью оксидов металлов является их электролитическая активность. Некоторые оксиды металлов, такие как окись меди или окись железа, способны взаимодействовать с водой и образовывать кислотные или щелочные растворы. Они могут проводить электрический ток и используются в электролитических процессах.
Однако не все оксиды металлов являются электролитами. Множество оксидов металлов, таких как оксид алюминия или оксид цинка, являются непроводящими веществами. Они не растворяются в воде и не могут проводить электрический ток. Такие оксиды металлов обычно применяются в качестве изоляционных материалов в электронике или строительстве.
Электролитические свойства оксида металла

Оксид металла обладает определенными электролитическими свойствами. Следует отметить, что в большинстве случаев оксиды металлов являются электролитами только в растворах или при повышенной температуре. В нормальных условиях оксиды металлов обычно не проводят электрический ток.
Электролитические свойства оксида металла обусловлены его структурой и способностью образовывать ионы в растворе. В растворе оксид металла распадается на ионы металла и кислорода. Именно ионы металла и кислорода обеспечивают проводимость раствора.
Важно отметить, что электролитические свойства оксида металла могут зависеть от его окислительно-восстановительного потенциала. Некоторые оксиды металлов могут быть более активными и обладать высокой проводимостью, в то время как другие оксиды металлов могут быть менее активными и иметь низкую проводимость.
Электролитические свойства оксида металла могут быть также изменены добавлением других веществ. Например, добавление кислоты или щелочи может изменить проводимость оксида металла в растворе. Это объясняется изменением pH раствора и влиянием добавленных веществ на структуру и свойства оксида металла.
Итак, оксид металла обладает электролитическими свойствами при определенных условиях, включая наличие растворителя или повышенную температуру. Эти свойства зависят от структуры оксида металла, его окислительно-восстановительного потенциала и возможности образования ионов в растворе.
Электролитическое влияние оксида металла на окружающую среду
Оксид металла влияет на окружающую среду через физические и химические процессы, которые происходят при его взаимодействии с водой, воздухом и другими веществами.
При контакте оксида металла с водой происходит процесс гидролиза, в результате которого образуется кислота или щелочь в зависимости от свойств оксида. Эти растворы могут повлиять на pH водной среды и состав микроэлементов, что влияет на биологические процессы.
Воздействие оксида металла на воздух происходит через окисление или восстановление оксида. В результате окисления может образовываться пыль, которая загрязняет воздух и может быть опасной при вдыхании. Кроме того, окисление оксида металла может приводить к коррозии металлических поверхностей.
Оксид металла может также взаимодействовать с другими веществами в окружающей среде, такими как минералы, органические соединения и другие химические вещества. Это может привести к образованию новых соединений и изменению их свойств, что может оказывать различное влияние на окружающую среду.
В целом, электролитическое влияние оксида металла на окружающую среду имеет сложный и многогранный характер. Понимание этих процессов и их влияния на окружающую среду позволяет разрабатывать методы контроля и предотвращения потенциального негативного воздействия оксида металла на окружающую среду.
Вопрос-ответ

Может ли оксид металла быть электролитом?
Да, оксид металла может быть электролитом, если в нем имеются ионные связи и он может проводить электрический ток. Например, оксид натрия (Na2O) может проводить ток, так как он разлагается на ионы натрия и оксида.
Какие оксиды металлов являются не электролитами?
Оксиды металлов могут быть не электролитами, если они обладают собственной структурой и наличием ковалентных связей, то есть не образуют ионов и не могут проводить электрический ток. Примером такого оксида может служить оксид углерода (CO), который не проводит ток и имеет молекулярную структуру.
