Неметаллы – это особый класс химических элементов, которые обладают некоторыми уникальными свойствами. Одним из самых интересных и важных свойств являются окислительные свойства неметаллов. Неметаллы могут быть сильными окислителями и взаимодействовать с металлами, образуя различные химические соединения.
Когда неметалл вступает в реакцию с металлом, происходит окисление металла, а неметалл сам восстанавливается. В результате реакции образуется новое вещество – оксид. Оксид – это химическое соединение, состоящее из неметалла и металла, где неметалл выступает в качестве окислителя.
Реакция между неметаллом и металлом может быть представлена в виде уравнения. Например, если неметаллом является хлор, а металлом – натрий, уравнение будет выглядеть следующим образом: Na + Cl2 -> 2NaCl. В этом уравнении видно, что натрий окисляется, а хлор восстанавливается, образуя хлорид натрия – NaCl.
Окислительные свойства неметаллов

Неметаллы обладают способностью выступать в качестве окислителей, то есть принимать электроны от других веществ. Это свойство является одним из основных отличий неметаллов от металлов. Окислительные свойства неметаллов проявляются при реакции с металлами, когда неметаллы выступают в качестве окислителей и окисляют металлы.
Реакция неметаллов с металлами протекает следующим образом: неметалл принимает электроны от металла, в результате чего неметалл окисляется, а металл восстанавливается. В этой реакции окисление неметалла происходит благодаря его высокой электроотрицательности.
Для описания реакций между неметаллами и металлами используются химические уравнения. Например, реакция хлора с натрием может быть записана следующим образом: Na + Cl2 → NaCl. В данном случае натрий окисляется, отдавая электроны хлору, который восстанавливается.
Различные неметаллы могут иметь различную активность в реакциях с металлами. Например, фтор является наиболее активным неметаллом и может реагировать со многими металлами, включая даже платину. В то же время, кислород обладает менее высокой активностью и реагирует только с некоторыми металлами, такими как железо.
Окислительные свойства неметаллов играют важную роль в химических процессах и реакциях в природе. Например, окислительные свойства кислорода позволяют ему участвовать в дыхании организмов, а окислительные свойства хлора используются для дезинфекции воды.
Реакция неметаллов с металлами
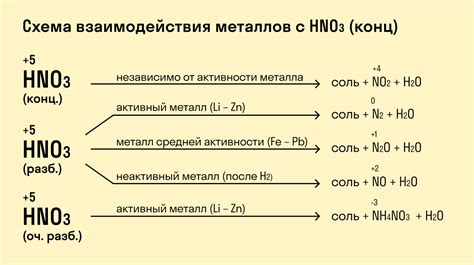
Неметаллы обладают окислительными свойствами и могут реагировать с металлами, совершая окисление металлов и сами восстанавливаясь. Реакции неметаллов с металлами являются важным физико-химическим явлением и находят применение в различных областях, таких как промышленность, электротехника, а также в повседневной жизни.
Одним из наиболее распространенных примеров реакции неметалла с металлом является реакция кислорода (O2) с металлами. Кислород имеет большую электроотрицательность и обладает сильными окислительными свойствами. При реакции с металлами кислород переходит в ионную форму, а металл окисляется. Эта реакция является основной причиной коррозии металлов, таких как железо, алюминий и магний.
Другим примером реакции неметалла с металлом является реакция хлора (Cl2) с металлами. Хлор также обладает сильными окислительными свойствами и может реагировать с металлами, в результате чего образуются соли металлов. Например, реакция хлора с натрием приводит к образованию хлорида натрия.
Реакция неметаллов с металлами может быть полезной в различных областях. Например, в химической промышленности реакция неметаллов с металлами может использоваться для получения различных соединений и материалов. В электротехнике реакция неметаллов с металлами может быть использована для создания гальванических элементов, которые являются источниками электроэнергии. Кроме того, реакция неметаллов с металлами может происходить и в повседневной жизни, например, при использовании реагентов для очистки поверхности металлических изделий.
Основные признаки окислительных свойств неметаллов
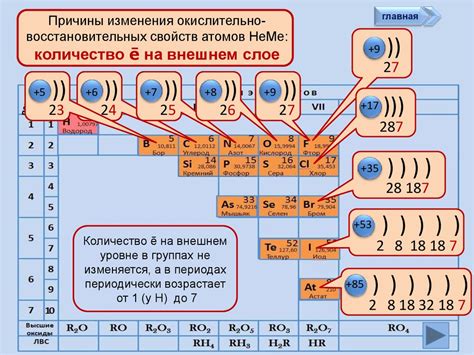
Окислительные свойства неметаллов представляют собой способность этих элементов в реакциях образовывать соединения с другими веществами, при этом сами неметаллы обретают положительный заряд.
Один из основных признаков окислительных свойств неметаллов – это их высокая электроотрицательность. Электроотрицательность – это способность атомов притягивать электроны к себе. Чем выше электроотрицательность атома, тем больше ионизации он обладает, и тем более сильным окислителем он является.
Другим признаком окислительных свойств неметаллов является их высокая энергия ионизации. Энергия ионизации – это энергия, необходимая для отрыва электрона от атома. Чем выше энергия ионизации у неметалла, тем сильнее он будет окислителем.
Окислительные свойства неметаллов проявляются в реакциях с металлами, в результате которых металлы окисляются, а неметаллы восстанавливаются. В таких реакциях неметаллы обычно принимают на себя электроны от металлов. Например, взаимодействие кислорода с железом приводит к образованию ржавчины – окиси железа, при этом кислород принимает электроны от железа.
Окислительные свойства неметаллов можно представить в виде таблицы, где будут указаны элементы, их электроотрицательность и энергия ионизации. Такая таблица поможет сравнить свойства различных неметаллов и определить их способность к окислительным реакциям.
Влияние окружающей среды на проявление окислительных свойств неметаллов

Окислительные свойства неметаллов определяются их способностью взаимодействовать с другими веществами и передавать электроны. Влияние окружающей среды на проявление этих свойств может быть значительным и зависит от многих факторов.
Первым и одним из самых важных факторов является концентрация кислорода в окружающей среде. Кислород является сильным окислителем и способен вызывать окисление неметаллов. В присутствии достаточного количества кислорода некоторые неметаллы, такие как водород, углерод и сера, образуют оксиды, в результате чего происходит окисление.
Температура также оказывает влияние на проявление окислительных свойств неметаллов. При повышении температуры происходит ускорение химических реакций, в том числе окислительных. Это может приводить к большему распространению окислительных процессов и увеличению скорости окисления неметаллов.
Окружающая среда также может предоставлять неметаллам различные вещественные и электрические условия, которые могут оказывать влияние на проявление их окислительных свойств. Например, наличие различных ионов в растворе может способствовать более эффективному взаимодействию неметаллов с металлами и вызывать сильнее окисление. Также электрическое поле может оказывать влияние на передачу электронов между неметаллами и металлами, что также может повлиять на проявление окислительных свойств неметаллов.
Выводы по влиянию окружающей среды на проявление окислительных свойств неметаллов могут быть разнообразными. Однако можно сказать, что окружающая среда играет важную роль в определении способности неметаллов проявлять свои окислительные свойства и может оказывать значительное влияние на химические процессы, в которых участвуют неметаллы.
Окислительные свойства неметаллов в уравнениях реакций

Неметаллы обладают выраженными окислительными свойствами, которые проявляются во время химических реакций с металлами. Окислительные свойства неметаллов позволяют им отбирать электроны у металлов и образовывать соединения, проявляющие сильную электроотрицательность.
Одна из наиболее известных реакций неметаллов с металлами – это реакция неметаллов с щелочными металлами, такими как натрий, калий, литий и др. В результате таких реакций образуется соединение, состоящее из иона неметалла и иона металла. Например, реакция кислорода с натрием представляется следующим уравнением:
2Na + O2 → 2Na+ + O2-
В данном уравнении натрий отдает свои электроны кислороду, который в результате становится отрицательно заряженным ионом. Натрий, соответственно, становится положительно заряженным ионом.
Также неметаллы проявляют окислительные свойства при реакциях с другими металлами, например, с медью. В данном случае происходит обмен электронами между неметаллом и металлом, в результате чего образуется соединение, содержащее ион неметалла и ион металла. Например, реакция хлора с медью представляется следующим уравнением:
2Cu + Cl2 → 2Cu2+ + 2Cl-
В данной реакции медь отдает два электрона, а хлор принимает эти электроны. В результате хлор превращается в ион с отрицательным зарядом, а медь становится ионом с положительным зарядом.
Таким образом, окислительные свойства неметаллов проявляются при их взаимодействии с металлами в химических реакциях и способны приводить к образованию различных ионов соединений.
Примеры реакций неметаллов с металлами

Неметаллы - это элементы, которые обладают высокой электроотрицательностью и не образуют положительных ионов. Когда неметалл вступает в реакцию с металлом, образуются соединения, в которых неметалл принимает отрицательный заряд. В результате таких реакций образуются соли или межметаллические соединения.
Один из примеров реакции неметалла с металлом - реакция кислорода с железом. Когда железо вступает в контакт с кислородом воздуха, происходит окисление железа, что можно наблюдать на поверхности металла в виде ржавчины. Уравнение реакции выглядит следующим образом: 4Fe + 3O2 → 2Fe2O3.
Другим примером реакции неметалла с металлом является реакция хлора с натрием. При прямом взаимодействии хлора с натрием образуется хлорид натрия, а при обратном - натриевый хлорат. Уравнение реакции можно записать так: 2Na + Cl2 → 2NaCl.
Еще одним примером реакции неметалла с металлом является реакция серы с медью. При нагревании серы с медью образуется сульфид меди. Уравнение реакции имеет вид: Cu + S → CuS.
Таким образом, реакции неметаллов с металлами происходят путём передачи электронов от металла к неметаллу, что приводит к образованию ионов и соединений. Эти реакции имеют большое значение в химической промышленности и являются основой для создания различных соединений и материалов.
Взаимодействие неметаллов с металлами в жидкой среде

Неметаллы проявляют окислительные свойства при взаимодействии с металлами, особенно в жидкой среде. Это связано с тем, что неметаллы в состоянии ионов захватывают электроны у металлов, что приводит к окислению последних.
Одной из наиболее ярких реакций взаимодействия неметаллов с металлами в жидкой среде является реакция хлора с натрием:
Na + Cl2 → NaCl
В данном случае, натрий отдает свои электроны хлору, которые при окислении образуют хлорид натрия.
Также часто используется реакция кислорода с металлами:
2M + O2 → 2MO
Эта реакция происходит, например, при сжигании металлов в воздухе. Кислород принимает электроны от металлов, окисляя их и образуя оксид металла.
Все эти реакции проявляются в жидкой среде, так как она обеспечивает удобные условия для перемещения ионов неметаллов и металлов, что облегчает процесс окисления металлов.
Вопрос-ответ

Какие свойства имеют неметаллы при взаимодействии с металлами?
Неметаллы обладают окислительными свойствами при взаимодействии с металлами. Они способны отнимать электроны у металлов, образуя соединения с положительными ионами металлов.
Какие реакции могут происходить между неметаллами и металлами?
В результате взаимодействия неметаллов с металлами могут происходить различные реакции. Например, некоторые неметаллы могут образовывать с металлами ионы, которые образуют соли, оксиды или гидроксиды. В других случаях неметалл может реагировать с металлом, выделяя газ или образуя сложные соединения.
Какие неметаллы обладают окислительными свойствами при взаимодействии с металлами?
Многие неметаллы могут обладать окислительными свойствами при взаимодействии с металлами. Например, хлор (Cl) может окислять некоторые металлы, такие как железо (Fe) или цинк (Zn), образуя хлориды металлов. Водород (H) также обладает окислительными свойствами при реакции с большинством металлов.
Как записать уравнение реакции между неметаллом и металлом?
Уравнение реакции между неметаллом и металлом записывается так, чтобы учесть сохранение массы и электрическую нейтральность. Например, уравнение реакции между хлором (Cl) и железом (Fe) выглядит следующим образом: 2Fe + 3Cl2 → 2FeCl3.
