Окисление – одна из основных химических реакций, происходящих с металлами. Под действием кислорода они стремятся образовать оксиды и гидроксиды. Это явление называется окислительными свойствами металлов. Однако, стоит отметить, что не все металлы имеют одинаковую активность, поэтому их окислительные свойства могут отличаться.
Окислительные свойства металлов обусловлены электронной структурой атомов. Внешняя электронная оболочка у металлов содержит от одного до трех электронов, которые легко отдаются. Таким образом, металлы, имеющие меньшее количество электронов во внешней оболочке, имеют большую активность и проявляют более сильные окислительные свойства.
Рост окислительных свойств металлов может быть обусловлен также их положением в периодической системе. Следуя снизу вверх и слева направо, активность металлов увеличивается из-за увеличения зарядов ядер. Кроме того, влияние химической активности также может оказываться со стороны окружающей среды.
Окислительные свойства металлов: полный обзор
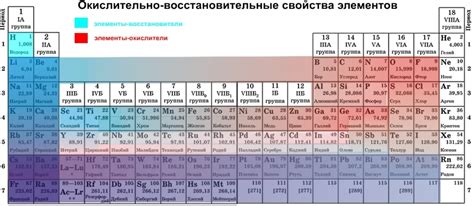
Окислительные свойства металлов представляют собой способность металлов образовывать соединения, в которых они находятся в положительной степени окисления.
Окисление металла является результатом его взаимодействия с кислотами, кислотными оксидами или веществами, содержащими активный кислород. В процессе окисления металлы утрачивают электроны, что приводит к образованию положительных ионов.
При этом, окислительные свойства металлов зависят от их электрохимической активности. Как правило, металлы с более низкой электрохимической активностью обладают меньшей способностью к окислению. Наиболее активные металлы, такие как щелочные металлы (например, натрий или калий), легко окисляются на воздухе или взаимодействуют с водой.
Однако, металлы с более высокой электрохимической активностью, как например, алюминий или железо, могут образовывать защитные пленки оксида на своей поверхности, которые служат барьером для дальнейшего окисления.
Окислительные свойства металлов имеют большое практическое значение. Например, они используются в химической промышленности для получения полезных соединений, а также в электротехнике и энергетике при производстве элементов батарей, аккумуляторов и проводов.
Окисление металлов: понятие и основные принципы

Окисление – это процесс, при котором металл соединяется с кислородом или другими элементами, приводящий к образованию окиси металла. Окисление является одним из основных способов взаимодействия металлов с окружающей средой.
Основной принцип окисления металлов заключается в том, что металлы имеют свойство отдавать электроны и становиться ионами положительной заряды. Это происходит в результате реакции металла с кислородом или другими веществами, содержащими активные атомы.
Окисление может протекать как в присутствии воды, так и без нее. Вода, как правило, является хорошим растворителем для окисляющих веществ, поэтому окисление металлов в большинстве случаев происходит в водной среде. Вода также способствует проникновению кислорода к металлу, что ускоряет процесс окисления.
Окисление металлов не является всегда нежелательным явлением. Некоторые металлы обладают устойчивой оксидной пленкой, которая защищает их от дальнейшего окисления. К таким металлам относятся, например, алюминий и цинк.
Однако, для некоторых металлов окисление может приводить к серьезному порче и разрушению. Например, железо окисляется воздухом, образуя ржавчину, которая разрушает его структуру. Поэтому важно знать и уметь контролировать окислительные свойства металлов, чтобы применять их сообразно их химической природе и условиям использования.
Рост окислительных свойств металлов с увеличением атомной массы
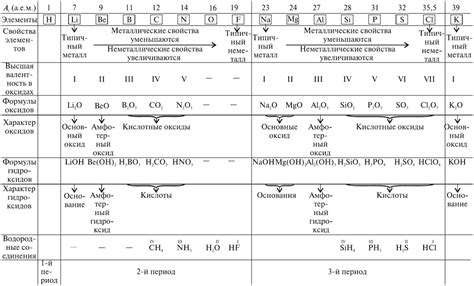
Окислительные свойства металлов имеют тесную связь с их атомной массой. С увеличением атомной массы металла наблюдается увеличение его активности и способности к окислению. Данный процесс обусловлен изменением электронной структуры атома металла, что приводит к большей легкости в отдаче электронов и, следовательно, к увеличению окислительных свойств.
Однако, стоит отметить, что не все металлы реагируют с веществами одинаково. Существует определенное упорядочение в росте окислительных свойств металлов с увеличением атомной массы. Например, активность алкалийных металлов увеличивается с увеличением их атомной массы по периоду. Алкалийные металлы первой группы (литий, натрий, калий и т.д.) проявляют высокую активность и легко окисляются воздухом и водой.
Также, с увеличением атомной массы в периоде, растет и окислительная активность металлов других групп. Например, магний (Mg) и алюминий (Al) реактивны, но не так сильно как литий (Li) или натрий (Na). Это связано с тем, что у металлов второй и третьей группы количества электронов во внешней оболочке становится больше, что уменьшает их окислительные свойства.
Таблица ниже иллюстрирует рост окислительных свойств металлов с увеличением атомной массы в периоде:
| Период | Металлы |
|---|---|
| 1 | Литий (Li), Натрий (Na), Калий (K), Рубидий (Rb), Цезий (Cs) |
| 2 | Магний (Mg), Алюминий (Al) |
| 3 | Титан (Ti), Хром (Cr), Железо (Fe) |
Интересно отметить, что с ростом атомной массы в периоде окислительные свойства металлов имеют тенденцию к снижению. Это связано с тем, что с увеличением атомной массы увеличивается количество электронов во внешней оболочке, что делает отдачу электронов тяжелее и уменьшает окислительную активность.
Влияние электроотрицательности на окислительные свойства металлов

Электроотрицательность играет важную роль в определении окислительных свойств металлов. Электроотрицательность вещества характеризует его способность принимать электроны и образовывать ионную связь. В случае металлов с более низкой электроотрицательностью, они имеют большую склонность отдавать электроны и тем самым выступать в роли окислителя.
Электроотрицательность входит в систему периодических свойств элементов и принимает значения от 0 до 4. Чем выше значение электроотрицательности элемента, тем больше его стремление принимать электроны и выступать в роли восстановителя. Это связано с тем, что элементы с высокой электроотрицательностью обладают большим числом электронов в своей валентной оболочке и меньшей атомной радиусом, что облегчает притяжение электронов и формирование ковалентных связей.
В таблице Менделеева можно наблюдать влияние электроотрицательности на окислительные свойства металлов. Металлы с более низкой электроотрицательностью, такие как натрий (Na) и магний (Mg), обладают большей склонностью отдавать электроны и тем самым окисляться. С другой стороны, металлы с более высокой электроотрицательностью, такие как кислород (O) и хлор (Cl), обладают большей склонностью принимать электроны и редуцировать другие вещества.
В общем случае, электроотрицательность является одним из факторов, определяющих окислительные свойства металлов, в силу своего влияния на процессы обмена электронами между веществами. Понимание этого взаимодействия позволяет предсказывать реакционные способности металлов и использовать их в различных химических процессах и технологиях.
Электролитическая потенциальная шкала и металлическая активность

Электролитическая потенциальная шкала является одним из инструментов для изучения окислительных свойств металлов и определения их металлической активности. Эта шкала представляет собой ряд металлов, упорядоченных по величине их потенциалов окисления.
Каждому металлу в электролитической потенциальной шкале соответствует свой особый потенциал окисления, который характеризует его способность к окислению. Металлы с более высокими потенциалами окисления (более положительными значениями) обладают большей активностью и проявляют большую склонность к окислительным реакциям.
Металлическая активность определяется не только потенциалами окисления металлов, но и другими факторами, такими как электроотрицательность, степень ионизации и др. Помимо этого, металлическая активность может варьироваться в зависимости от условий окружающей среды, влияния других химических веществ и температуры.
Для определения металлической активности металлов часто используют таблицу активности металлов, основанную на электролитической потенциальной шкале. В этой таблице металлы располагаются в порядке убывания их активности, что позволяет предсказывать возможность окисления одних металлов другими и выбирать материалы для различных химических процессов.
Причины роста окислительных свойств металлов

Окислительные свойства металлов, то есть их способность вступать в химическую реакцию с кислородом, могут различаться в зависимости от разных факторов. Существуют несколько причин, которые могут приводить к увеличению окислительных свойств металлов.
Во-первых, с ростом атомного радиуса металлов возрастает их окислительная способность. Больший радиус атома позволяет электронам передвигаться свободнее и делает металл более активным в реакциях с кислородом.
Во-вторых, металлы с более низкой электроотрицательностью имеют более высокую окислительную способность. Электроотрицательность характеризует способность атомов металлов притягивать к себе электроны, и чем она ниже, тем более положительно заряжен ион металла и тем активнее он может реагировать с кислородом.
Также влияние на окислительные свойства металлов оказывают концентрация кислорода и температура окружающей среды. Повышенная концентрация кислорода или высокая температура способствуют активизации окислительных реакций с металлами, увеличивая их окислительную способность.
Наконец, структура и состояние поверхности металла также играют важную роль в росте его окислительных свойств. Например, поверхность металла с большим количеством дефектов или микронеровностей может образовывать больше активных центров для взаимодействия с кислородом, что усиливает окислительные реакции.
Вопрос-ответ

Какие металлы имеют окислительные свойства?
Окислительные свойства характерны для большинства металлов в периодической системе. Некоторые из самых активных окислителей - щелочные и щелочноземельные металлы, такие как натрий, калий, магний и кальций.
Почему металлы обладают окислительными свойствами?
Металлы обладают окислительными свойствами из-за структуры их атомов. Внешние электроны у металлов слабо связаны с ядром и могут легко передаваться другим веществам. Когда металлы окисляются, они теряют электроны и образуют положительно заряженные ионы, которые способны взаимодействовать с другими веществами и окислять их. В итоге металл сам становится окислителем.
