Металлы 2 группы периодической системы характеризуются высокой активностью и кислотными окислительными свойствами. Они способны образовывать соединения со многими неактивными неметаллами и окислять их во время химических реакций.
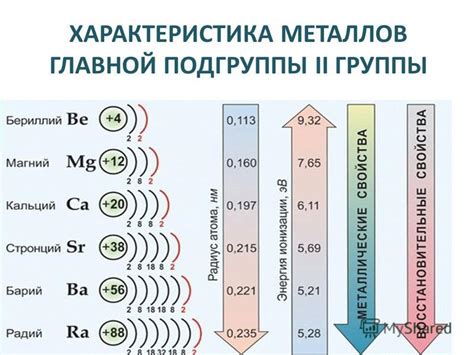
Вторая группа металлов включает в себя такие элементы, как бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти элементы имеют два валентных состояния и в химических реакциях обычно получают положительные ионы.
Металлы 2 группы реагируют с неметаллами, такими как кислород, сера, фосфор и галогены. Они окисляются при взаимодействии с кислородом, что приводит к образованию оксидов металлов. Эти соединения обычно обладают высокой степенью солевого характера и являются основаниями, взаимодействуя с кислотами.
Окисление ионов металлов 2 группы происходит в результате потери электронов, образования положительных ионов и образования соединений с отрицательно заряженными ионами неметаллов. Окислительные свойства этих металлов также связаны с их химической реакцией с водой и растворами кислот, что приводит к образованию водорода и ионов металла в растворе.
Металлы 2 группы
Металлы 2 группы периодической системы химических элементов включают в себя цинк (Zn), кадмий (Cd) и ртуть (Hg). Они обладают различными физическими и химическими свойствами, но имеют общую особенность - умеренное окислительное действие.
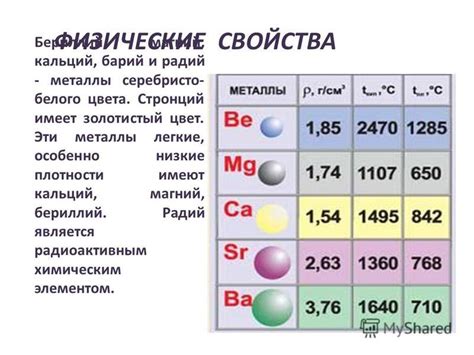
Цинк - это серебристо-серый металл, хорошо проводящий тепло и электричество. Он относительно недолговечен в воздухе и образует защитную пленку оксида на своей поверхности, предотвращая дальнейшую коррозию. Однако при повышенных температурах или во влажной среде цинк может реагировать с кислородом и образовывать оксиды. Это делает его слабым окислителем и позволяет использовать его в качестве защитной покрытия для других металлов.
Кадмий - также серебристо-серый металл, который обладает высокой температурной и коррозионной стойкостью. Он может реагировать с кислородом и образовывать оксиды, но эта реакция происходит медленнее, чем у цинка. Кадмий также может образовывать окислы, такие как кадмиевый оксид и кадмиевый сульфид, которые обладают умеренными окислительными свойствами.
Ртуть - единственный металл второй группы, который является жидким при комнатной температуре. Она серебристо-белого цвета и не реагирует с кислородом, поэтому не образует оксиды в обычных условиях. Однако ртуть может реагировать с другими элементами, образуя соединения, которые обладают окислительными свойствами.
Описание металлов 2 группы
Металлы 2 группы элементов характеризуются особыми свойствами и химическим поведением. В эту группу входят 6 химических элементов: магний (Mg), цинк (Zn), кадмий (Cd), ртуть (Hg), медь (Cu) и свинец (Pb).
Магний является легким, мягким и очень реактивным металлом. Он вступает в реакцию с кислородом даже при обычных температурах, образуя оксид магния (MgO). Магний также способен сжигаться на воздухе с ярким пламенем.
Цинк обладает хорошей коррозионной стойкостью и используется в качестве защитного покрытия для других металлов. Он реагирует с кислородом только при повышенных температурах. Цинк также может растворяться в кислотах и образовывать соединения с различными элементами.
Кадмий является тяжелым металлом, похожим на цинк. В отличие от цинка, кадмий менее реактивен с кислородом и образует оксид кадмия (CdO) только при нагревании. Он также является токсичным металлом и требует особой осторожности при его использовании.
Ртуть является единственным металлом, который находится в жидком состоянии при комнатной температуре. Она обладает высокой плотностью и отличными электрическими свойствами. Ртуть вступает в реакцию с кислородом, образуя оксид ртути (HgO).
Медь является хорошим электропроводником и отличается высокой теплопроводностью. Она непротиворечива кислороду и вступает в реакцию только при нагревании в присутствии кислорода. Медь широко используется в промышленности для производства электрических проводов и различных изделий.
Свинец является тяжелым, мягким и пластичным металлом. Он обладает хорошей коррозионной стойкостью и используется в различных промышленных отраслях. Свинец также является токсичным и его использование требует особой осторожности.
Вопрос-ответ

Какие металлы относятся к металлам 2 группы?
Металлы 2 группы включают в себя цинк (Zn), кадмий (Cd) и ртуть (Hg).
Какие окислительные свойства имеют металлы 2 группы?
Металлы 2 группы имеют сравнительно низкие окислительные свойства. Они способны отдавать электроны только в реакции с более высокоокислительными веществами.
Как происходит окисление металлов 2 группы?
Окисление металлов 2 группы происходит путем потери электронов. Металлы 2 группы образуют ионы со зарядом +2, отдавая 2 электрона. Например, цинк (Zn) превращается в ион Zn^2+ при окислении.
Какие вещества являются сильными окислителями для металлов 2 группы?
Сильными окислителями для металлов 2 группы являются вещества с более высоким стандартным потенциалом окисления. Например, кислород (O2) и хлор (Cl2) могут окислить металлы 2 группы, образуя соответствующие оксиды и хлориды.
