Окислительная активность кислот является одним из основных свойств химического вещества, определяющих его способность взаимодействовать с другими веществами, в том числе с металлами. Кислоты обладают электронной парностью, что позволяет им принимать электроны от других веществ, проявляя окислительные свойства.
Металлы, в свою очередь, являются хорошими донорами электронов, что делает их подходящими объектами для взаимодействия с кислотами. При взаимодействии металлов с кислотами происходит передача электронов от металла к кислоте, при которой металл окисляется, а кислота восстанавливается.
Важно отметить, что активность кислот может различаться в зависимости от их состава и структуры. Например, некоторые кислоты, такие как сероводородная кислота или соляная кислота, обладают высокой окислительной активностью и могут вызывать интенсивное взаимодействие с металлами. В то же время, другие кислоты, например, азотная кислота или серная кислота, могут иметь более слабое взаимодействие с металлами.
Взаимодействие кислот с металлами может приводить к образованию солей или газов. Например, при взаимодействии соляной кислоты с металлом натрия образуется хлорид натрия и выделяется водородный газ. Эти реакции играют важную роль в химической промышленности и научных исследованиях, а также имеют практическое применение в различных областях жизни.
Окислительная активность кислот
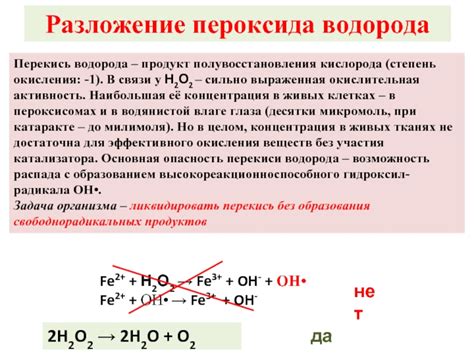
Окислительная активность кислот – это их способность выделять ион водорода (протон) и принимать электроны от веществ, находящихся в низшей степени окисления. Каждая кислота имеет свою окислительную активность, которая зависит от ее структуры и химических свойств.
Окислительные свойства кислот могут быть использованы в различных химических реакциях. Например, кислота может окислить металл, отдавая ему свои электроны и сама превращаясь в вещество с более низкой степенью окисления. Такие реакции особенно активны при высокой концентрации кислоты или при высоких температурах.
Взаимодействие кислот с металлами может привести к образованию солей и выделению газов, например, взаимодействие соляной кислоты с металлом цинка приводит к образованию хлорида цинка и выделению молекул водорода. Такие реакции широко применяются в химической промышленности и лабораторных условиях для получения ценных продуктов или их анализа.
Пример использования окислительной активности кислот можно привести в области гальванической коррозии. Если металл находится в контакте с кислотой, то является анодом в электрохимической реакции, выделяющей электроны и ионы металла в кислотную среду. Это может привести к разрушению металла и образованию коррозионных продуктов.
- Окислительная активность кислот может быть определена по их электродным потенциалам, которые характеризуют их способность выделять электроны.
- Для ряда кислот существуют складкиовые таблицы, показывающие их активность по отношению к металлам. Например, в сильных окислителях входят соляная и азотная кислоты, которые могут реагировать с большим числом металлов.
Механизм окисления металлов

Механизм окисления металлов является важным процессом в химии и имеет глубокое фундаментальное значение. Он определяет взаимодействие металлов с окружающей средой и обусловливает их поведение при контакте с кислотами и другими окислителями.
Окисление металлов осуществляется путем передачи электронов между металлом и окислителем. Когда металл контактирует с кислотой, происходит взаимодействие ионов металла и ионов водорода (H+). Металлические ионы окисляются, отдавая электроны окислителю, в нашем случае – кислороду. Это процесс передачи электронов называется окислительной реакцией, а металл сам является веществом, подвергающимся окислению.
Механизм окисления металлов может различаться в зависимости от свойств самих металлов и их взаимодействия с кислотами. Например, активные металлы, такие как натрий и калий, легко окисляются и реакция с кислотой происходит очень быстро и с выделением энергии в виде тепла. Менее активные металлы, например, железо или медь, окисляются с меньшей скоростью и реакция, обычно, не сопровождается выделением тепла.
Механизм окисления металлов можно проиллюстрировать таблицей активностей металлов. В такой таблице металлы располагаются в порядке их активности по отношению к окислителям. Так, самые активные металлы, такие как литий или калий, располагаются в верхней части таблицы, а наиболее пассивные, такие как серебро или золото, – в нижней части. Используя такую таблицу, можно предсказать, какой металл будет активнее реагировать с кислотами или другими окислителями.
Классификация кислот по окислительной активности
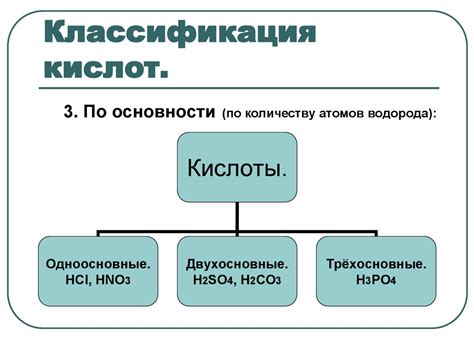
В химии кислоты классифицируют по своей окислительной активности. Исходя из этого, кислоты делят на три основных типа: сильные окислители, умеренные окислители и слабые окислители. Каждый тип кислот обладает определенной способностью к окислительным реакциям, которая зависит от их электрохимических свойств.
Сильные окислители - это кислоты, которые способны сильно окислять другие вещества. Они обладают высоким окислительным потенциалом и быстро окисляют соединения, образуя обычно кислород или его производные вещества. Примерами сильных окислителей являются хлорная кислота, перманганат калия и персульфат аммония.
Умеренные окислители - это кислоты, у которых окислительный потенциал ниже, чем у сильных окислителей, но выше, чем у слабых окислителей. Они могут окислять другие вещества, но не настолько энергично, как сильные окислители. Примерами умеренных окислителей являются серная кислота, сернистая кислота и хлорсульфоновая кислота.
Слабые окислители - это кислоты с низким окислительным потенциалом, которые не способны сильно окислять другие вещества. Они обычно окисляют соединения лишь до определенного уровня и не образуют кислород или его производные вещества. Примерами слабых окислителей являются уксусная кислота, лимонная кислота и аскорбиновая кислота.
Классификация кислот по окислительной активности представляет собой удобный способ систематизации и понимания их взаимодействия с другими веществами. Это помогает ученым и химикам более точно определить возможные химические реакции и свойства данных кислот в различных условиях.
Влияние окружающей среды на окислительную активность кислот

Окислительная активность кислот является ключевым свойством данных соединений. Одним из факторов, влияющих на окислительную активность кислот, является окружающая среда, в которой они находятся. Реакция кислот с металлами, например, происходит под влиянием окислительной среды, в которой протекает данная реакция.
Одной из важных характеристик окружающей среды является ее кислотность или щелочность, которая определяет степень окислительной активности кислоты. Если окружающая среда обладает кислотными свойствами, то реакция кислоты с металлом происходит более интенсивно и быстро. В результате окислительная активность кислоты значительно увеличивается.
Также влияние окружающей среды на окислительную активность кислот включает и наличие других веществ, которые могут обладать окислительными свойствами. Например, наличие кислорода или перекиси водорода в окружающей среде приводит к усилению окислительной активности кислоты. Такие вещества могут служить дополнительными источниками кислорода для окислительных реакций.
Все вышеперечисленные факторы указывают на то, что окружающая среда играет важную роль в процессах окисления, с которыми связана окислительная активность кислот. Понимание влияния окружающей среды на окислительную активность кислот является важным для проведения различных химических реакций и процессов, а также для определения условий, при которых происходят данные реакции и процессы.
Взаимодействие кислот с металлами
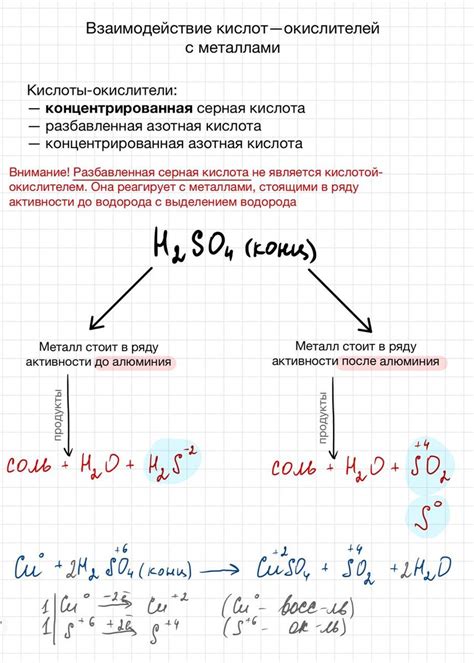
Взаимодействие кислот с металлами – это процесс, при котором кислоты реагируют с металлическими элементами, приводя к их окислению и образованию соответствующих солей и водорода. Кислоты обладают окислительной активностью, поэтому они способны выступать в роли окислителей при взаимодействии с металлами.
При контакте кислоты с металлом происходит перенос электронов от металла к кислоте, что приводит к окислению металла. В результате этого процесса образуется соответствующая соль металла и выделяется водородный газ. Взаимодействие кислоты с металлом можно представить уравнением химической реакции:
Металл + Кислота → Соль металла + Водород
Скорость реакции и интенсивность выделения водорода зависят от ряда факторов, включая концентрацию кислоты, активность металла, его поверхность и температуру окружающей среды. Некоторые металлы, такие как магний и алюминий, взаимодействуют более активно с кислотами, образуя реакции с высокой интенсивностью выделения водорода. Кроме того, интенсивность реакции может быть усилена использованием катализаторов или повышением температуры реагентов.
Взаимодействие кислот с металлами имеет много практических применений в химической промышленности и лабораторной практике. Кислоты, такие как серная и соляная, широко используются в процессах очистки металлических поверхностей от окислов и примесей. Они также используются для выделения различных металлов из руд и создания специализированных сплавов.
Таким образом, взаимодействие кислот с металлами представляет собой важный процесс в химии, который способствует окислению металлов и образованию солей и водорода. Оно имеет широкое применение в различных областях, включая промышленность и научные исследования.
Окисление металлов кислотами

Окисление металлов кислотами представляет собой процесс взаимодействия металла с кислотой, в результате которого металл подвергается окислению. При этом происходит перенос электронов от металла к кислороду, что приводит к образованию соответствующих окислительных форм металла.
Окисление металлов кислотами может протекать с различной интенсивностью в зависимости от свойств и концентрации кислоты, а также от свойств металла. Некоторые металлы, например, магний или алюминий, обладают высокой активностью и с легкостью окисляются кислотами. Другие металлы, например, золото или платина, обладают низкой активностью и не окисляются кислотами.
Окисление металлов кислотами может протекать при различных условиях. Например, окисление цинка кислотой соляной протекает при обычной температуре и образует хлорид цинка и водород. Окисление же железа кислотами может требовать повышенной температуры и образования дополнительных соединений, например, сернокислого железа.
В ходе окисления металлов кислотами могут образовываться различные промежуточные соединения и окислительные формы металла. Это может влиять на процесс окисления и приводить к образованию особо активных соединений, которые могут быть использованы в различных химических процессах и промышленности.
Образование солей при взаимодействии кислот с металлами

Когда кислоты вступают в реакцию со металлами, образуется группа соединений, называемых солями. В результате этой реакции, происходит окисление металла и образование ионов металла, которые связываются с анионами кислоты, образуя соединение цельного кристаллического строения.
Реактивность кислот при взаимодействии с металлами может изменяться в зависимости от их химических свойств и концентрации. Примерами реакций являются реакции соляной кислоты с металлическим цинком или серной кислоты с металлическим железом.
При взаимодействии соляной кислоты с цинком образуется хлорид цинка (ZnCl2) и выделяется водород (H2). Реакция можно представить следующим образом:
Zn + 2HCl -> ZnCl2 + H2
Аналогично, при реакции серной кислоты с железом образуется сульфат железа (FeSO4) и выделяется водород (H2):
Fe + H2SO4 -> FeSO4 + H2
Таким образом, реакция кислот с металлами приводит к образованию солей и выделению газа, который можно обнаружить по характерным признакам, таким как пузырьки или пламя при поджигании.
В зависимости от типа кислоты и металла, реакция может протекать с разной интенсивностью и скоростью, и может сопровождаться различными эффектами, обусловленными образованием газов или изменениями температуры.
Вопрос-ответ

Что такое окислительная активность кислот?
Окислительная активность кислот - это способность кислоты отдавать электроны или получать протоны при взаимодействии с другими веществами.
Как происходит взаимодействие кислот с металлами?
При взаимодействии кислот с металлами происходит обмен протонов между кислотой и металлом. Кислота отдаёт протоны металлу, образуя одновременно воду, а металл отдает свои электроны кислороду из кислоты, образуя оксид металла. Это протекает по следующей схеме: кислота + металл -> соль + водород.
Какие кислоты обладают большей окислительной активностью?
Кислоты, обладающие более низкой степенью окисления, имеют большую окислительную активность. Например, хлорная кислота (HClO) обладает большей окислительной активностью, чем хлорноватистая кислота (HClO2).
