Окислительно восстановительные свойства ионов металлов являются одной из основных характеристик, определяющих их химическую активность и способность проводить электрический ток. Эти свойства связаны с изменением валентности металла, то есть с его способностью переходить из одного состояния окисления в другое при взаимодействии с другими веществами. Окисление и восстановление металлов играют важную роль во многих процессах, в том числе в химическом производстве, электрохимии, биологии и экологии.
Металлы могут проявлять окислительные свойства, когда они теряют электроны, переходя из более низкой в более высокую степень окисления. Это реакции окисления, в которых металл становится ионом положительного заряда. Одновременно с окислением происходит восстановление другого вещества, которое получает электроны от металла и приобретает отрицательный заряд. Восстановление металлов, наоборот, предполагает получение металлом электронов и переход из высшей в низшую степень окисления.
Ионные формы металлов с разными степенями окисления обладают различными окислительно восстановительными свойствами. Некоторые металлы, такие как железо или медь, способны к нескольким степеням окисления и могут выступать как окислители, так и восстановители. Их окислительные свойства играют важную роль, например, в биологических процессах, где они участвуют в дыхании клеток и обеспечивают перенос электронов.
Окислительно восстановительные свойства ионов металлов имеют широкое применение в различных областях науки и промышленности. Например, они используются в производстве металлов, при получении кислорода, хлора и других веществ, а также в электрохимических процессах. Они также находят применение в аналитической химии для определения концентрации веществ, а в медицине – в диагностике и лечении некоторых заболеваний.
Окислительно восстановительные свойства ионов металлов

Окислительно восстановительные свойства ионов металлов являются одной из ключевых особенностей химической активности этих элементов. Ионы металлов имеют способность окислять или восстанавливать другие вещества, что делает их важными участниками химических реакций.
Окислительные свойства ионов металлов основаны на их способности отдавать электроны, приобретенные во время ионизации. Это приводит к образованию положительно заряженных ионов, которые могут вступать в реакции с другими веществами, принимая на себя электроны и тем самым окисляя их.
Восстановительные свойства ионов металлов проявляются в их способности принимать на себя электроны из других веществ. При этом ионы металлов становятся восстановленными, т.е. приобретают отрицательный заряд, а другие вещества окисляются, теряя электроны.
Эти свойства ионов металлов находят широкое применение в различных областях науки и техники. Например, в химическом анализе ионные реакции металлов используются для определения концентрации различных веществ в пробе. В области электрохимии металлы используются как электроды в гальванических элементах и аккумуляторах, где происходят окислительно-восстановительные процессы. Также ионы металлов могут служить катализаторами в химических реакциях.
Принципы окислительно-восстановительных реакций
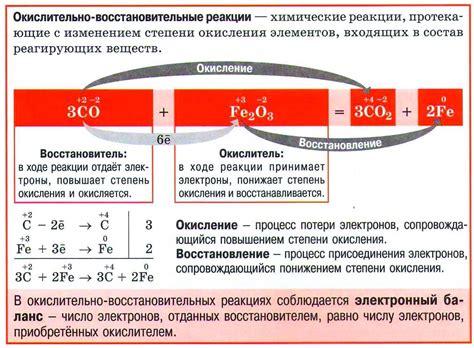
Окислительно-восстановительные реакции - это особый тип химических превращений, в которых происходит передача электронов между реагентами. В таких реакциях один из реагентов увеличивает свой степень окисления (становится окислителем), а другой реагент уменьшает свой степень окисления (становится восстановителем). Принципы этих реакций основаны на законе сохранения массы и законе сохранения электрического заряда.
Один из основных принципов окислительно-восстановительных реакций - это принцип сохранения электронов. В ходе реакции количество переданных электронов у окислителя должно быть равно количеству полученных электронов у восстановителя. Это связано с тем, что электроны не могут появиться или исчезнуть из ниоткуда, они только передаются от одного вещества к другому.
Другим важным принципом является принцип сохранения массы. В химической реакции общая масса реагентов должна быть равна общей массе продуктов. Это означает, что при окислении одного реагента другой реагент получает необходимое количество электронов, а это сопровождается изменением его химической формулы и массы.
Ионные соединения часто используются в окислительно-восстановительных реакциях. Здесь металлы играют роль восстановителя или окислителя, передавая электроны. Например, в реакции между медным купоросом (CuSO4) и цинком (Zn) медь окисляется до двухвалентного иона, а цинк восстанавливается до иона Zn2+. Такие реакции имеют широкое применение в различных областях, таких как электрохимия, гальванические элементы, производство металлов и др.
Окислительно восстановительные свойства ионов металлов

Окислительно-восстановительные свойства ионов металлов характеризуют их способность претерпевать окисление и восстановление в химических реакциях. Эти свойства играют важную роль в различных процессах, таких как электрохимические реакции, синтез органических соединений, окисление и восстановление воды и других веществ.
Ионы металлов могут действовать как окислители, передавая электроны другому веществу, или как восстановители, принимая электроны от другого вещества. Эти процессы часто сопровождаются изменением окислительного состояния ионов металлов, и восстановленные и окисленные ионы металла занимают разные места в реакционных уравнениях.
Применение окислительно-восстановительных свойств ионов металлов находит широкое применение в различных отраслях промышленности и научных исследованиях. Например, электрохимические реакции, основанные на окислительно-восстановительных свойствах ионов металлов, используются в процессах электролиза для получения чистых металлов из их соединений.
Другим примером является использование окислительно-восстановительных свойств ионов металлов в аналитической химии. Методы определения концентрации ионов различных металлов базируются на их способности окислять или восстановить другие вещества. Это позволяет проводить точный и чувствительный анализ различных проб, в том числе в медицине и экологии.
Кроме того, окислительно-восстановительные свойства ионов металлов используются в электронике и батареях. Ионы металлов таких как литий, никель и кобальт, способны перемещаться между положительным и отрицательным электродами, обеспечивая электрохимическую реакцию и производя электрический ток. Это позволяет создавать мощные источники питания, используемые в устройствах, таких как смартфоны и электромобили.
Влияние окружающей среды на реакции окисления и восстановления металлов

Оксидоредукционные реакции, связанные с окислением и восстановлением металлов, сильно зависят от химической природы окружающей среды. Реакции окисления и восстановления металлов могут происходить с разной скоростью и эффективностью в зависимости от типа окружающих веществ.
Оксидоредукционные реакции могут происходить в различных средах: водных растворах, кислородной атмосфере или газовой среде. Например, вода может служить окислителем или восстановителем в различных условиях. Металлы, такие как цинк, активно окисляются водой при контакте с ней, что происходит при ржавлении металла. В этом случае вода действует как окислитель.
Окружающая среда также может влиять на скорость окисления или восстановления металлов. Например, в кислой среде, содержащей кислород, окисление металлов происходит быстрее, чем в щелочной среде. Окислительные свойства ионов металлов могут быть усилены или ослаблены в зависимости от pH окружающей среды.
Окружающая среда также может повлиять на продукты реакции окисления или восстановления металлов. Например, в присутствии различных ионов в растворе могут образовываться осадки или растворимые соединения металла. Кроме того, в зависимости от условий окружающей среды, окисленные или восстановленные металлы могут образовывать различные соединения и обладать разной степенью активности.
Роль окислительно-восстановительных реакций в промышленности
Окислительно-восстановительные реакции, основанные на свойствах ионов металлов, играют важную роль в промышленности и находят применение в различных отраслях производства.
Металлургия: Одним из основных направлений использования окислительно-восстановительных реакций в промышленности является металлургия. С помощью реакций окисления и восстановления металлы извлекают из руды и придают им необходимые свойства. Например, в процессе производства стали, железо восстанавливают при помощи коксового газа или природного газа, а окисление проводят с помощью кислорода.
Электрохимическая промышленность: Окислительно-восстановительные реакции также широко применяются в электрохимической промышленности. Например, в процессе электролиза, приложение электрического тока позволяет провести окисление и восстановление ионов металлов, что позволяет производить различные химические соединения. Это находит применение в производстве кислорода, хлора, алюминия и других веществ.
Химическая промышленность: Окислительно-восстановительные реакции играют значительную роль в химической промышленности. Они используются для получения и очистки различных веществ. Например, использование окисления и восстановления помогает получить различные органические и неорганические соединения, такие как алкоголи, карбонаты, спирты и др.
Энергетика: Окислительно-восстановительные реакции играют важную роль в энергетике. Они участвуют в процессах горения и сжигания различных топлив, таких как углеводороды и уголь. При этом происходит окисление топлива и восстановление веществ, а освобождающаяся энергия затем используется для получения электроэнергии или других видов энергии.
Таким образом, окислительно-восстановительные реакции играют важную роль в различных отраслях промышленности, позволяя получать и преобразовывать различные вещества, а также производить энергию.
Применение ионов металлов в аналитической химии

Ионы металлов широко используются в аналитической химии для определения различных химических веществ. Они играют важную роль в процессе анализа, позволяя определить наличие или количество конкретного компонента в образце.
Одним из основных способов применения ионов металлов является ионный обмен, когда металлический ион замещает другой ион в образце. Этот процесс основывается на различии в реакционной способности ионов металлов, что позволяет проводить селективные анализы разных веществ.
Также ионы металлов используются в качестве окислителей или восстановителей в реакциях анализа. Например, перманганатные ионы MnO4- восстанавливаются до марганцевых ионов Mn2+. Этот процесс можно использовать для определения содержания органических веществ в образце.
Другим методом, в котором применяются ионы металлов, является комплексообразование. Многие металлы способны образовывать комплексы с различными соединениями, что позволяет определить содержание или наличие определенного компонента. Например, Fe3+ образует комплекс с салицилатом, а Ag+ - с хлоридами.
Ионы металлов также используются в анализе с помощью методов электрохимии. Например, метод вольтамперометрии основан на измерении тока, проходящего через электрод, покрытый ионами металла. Другой метод - амперометрия, основанная на измерении тока, проходящего через электрод с металлическим ионом.
В конечном счете, применение ионов металлов в аналитической химии позволяет проводить точные и селективные анализы различных веществ и компонентов в различных образцах. Это эффективный инструмент для определения состава различных материалов и для контроля качества продукции в различных отраслях промышленности.
Использование окислительно-восстановительных свойств металлов в медицине

Окислительно-восстановительные свойства металлов широко применяются в медицине. Многие ионы металлов обладают способностью окислять или восстанавливать другие вещества, что может быть полезно для лечения различных заболеваний и ран.
Один из примеров использования окислительно-восстановительных свойств металлов - лечение инфекций. Например, серебро, содержащееся в некоторых антисептиках, обладает способностью окислять белки и ДНК бактерий, что помогает уничтожить патогены и предотвратить развитие инфекции.
Другой пример - использование окислительно-восстановительных свойств металлов в регенеративной медицине. Ионы металлов, например, железо, медь и цинк, могут играть важную роль в процессе регенерации тканей. Они участвуют в окислительно-восстановительных реакциях, которые необходимы для образования новых клеток и тканей в организме.
Также, окислительно-восстановительные свойства металлов могут использоваться для создания имплантатов и медицинских материалов, обладающих антимикробными свойствами. Например, ионы меди могут убивать бактерии на поверхности имплантатов, что предотвращает развитие инфекций и способствует более быстрому заживлению ран.
Использование окислительно-восстановительных свойств металлов в медицине имеет свои преимущества и ограничения. Они могут быть эффективными в лечении некоторых заболеваний и помочь восстановить ткани, однако, необходимо учитывать их потенциальную токсичность и возможные побочные эффекты. Поэтому, перед использованием окислительно-восстановительных свойств металлов в медицине необходимо проводить тщательные исследования и клинические испытания для оценки их безопасности и эффективности.
Коррозия металлов и ее связь с окислительно-восстановительными реакциями

Коррозия металлов - это процесс разрушения и повреждения поверхности металла под воздействием окружающей среды. Один из основных механизмов коррозии заключается в осуществлении окислительно-восстановительных реакций между металлом и окружающей его средой.
Окислительно-восстановительные реакции происходят между ионами металлов и другими веществами, где ионы металла могут выступать как окислители или восстановители. Окисление - это процесс потери электронов, а восстановление - получение электронов. В результате этих реакций металл постепенно разрушается, а его поверхность покрывается окисными пленками и коррозионными продуктами.
Скорость коррозии зависит от ряда факторов, включая состав металла, свойства окружающей среды, температуру, влажность и т.д. Некоторые металлы, такие как цинк и алюминий, проявляют высокую степень коррозионной стойкости благодаря формированию защитных оксидных пленок на их поверхности. В то время как другие металлы, например, железо, обладают низкой коррозионной стойкостью, что обусловлено неспособностью образовывать защитные пленки.
Предотвращение коррозии и сохранение металлических конструкций требуют применения специальных методов и технологий. Это может включать использование коррозионностойких материалов, антикоррозионных покрытий, регулирование окружающей среды и т.д. Также эффективным способом борьбы с коррозией является использование металлов с высокой коррозионной стойкостью и специальных сплавов, которые могут образовывать плотные и стабильные окисные пленки на своей поверхности, защищая металл от дальнейшего разрушения.
Перспективы исследования окислительно-восстановительных свойств металлов
Окислительно-восстановительные свойства металлов представляют большой интерес для научных исследований в различных областях. Они имеют применение в электрохимии, каталитических процессах, синтезе материалов, металлургии и других технологических процессах. Изучение этих свойств позволяет разрабатывать новые материалы и технологии, повышать эффективность процессов и создавать более устойчивые и экологически безопасные системы.
Применение окислительно-восстановительных свойств металлов в электрохимии является особенно важным. Они используются в различных электрохимических процессах, таких как электролиз, гальваническое покрытие, аккумуляторные батареи и другие. В данной области исследуются механизмы окисления и восстановления металлов, электрохимические реакции и условия, при которых происходят данные процессы.
Интерес представляет и исследование окислительно-восстановительных свойств металлов в каталитических процессах. Металлы могут выступать в роли катализаторов, участвуя в окислительно-восстановительных реакциях и повышая скорость протекания процесса. Изучение этих свойств позволяет оптимизировать и усовершенствовать каталитические системы, а также разрабатывать новые эффективные катализаторы для различных химических и энергетических процессов.
Еще одной перспективной областью исследования окислительно-восстановительных свойств металлов является синтез и модификация материалов. Металлы могут применяться в качестве реагентов или катализаторов для синтеза различных органических соединений, полимеров, наночастиц и других материалов. Понимание механизмов окисления и восстановления металлов позволяет создавать новые способы синтеза и модификации материалов с заданными свойствами.
Вопрос-ответ

Какие металлы обладают окислительно-восстановительными свойствами?
Окислительно-восстановительные свойства имеют многие металлы, включая железо, медь, цинк, алюминий, свинец, никель и многие другие. Особенно высокие окислительные способности у металлов, которые находятся в правой части периодической системы элементов.
Зачем нужно знать окислительно-восстановительные свойства ионов металлов?
Знание окислительно-восстановительных свойств ионов металлов имеет большое значение в химии и технологии. Во-первых, они позволяют понять, как происходят реакции окисления и восстановления в химических системах. Во-вторых, они являются основой для создания электрохимических элементов и батарей. Например, знание способности ионов лития входить в реакции окисления и восстановления легло основу разработки литий-ионных аккумуляторов.
В чем заключаются основные принципы окислительно-восстановительных реакций?
Окислительно-восстановительные реакции основаны на передаче электронов между веществами. Металлы, которые обладают способностью отдавать электроны, называются окислителями, а вещества, принимающие эти электроны, - восстановителями. В реакции окисления окислители снижают свою степень окисления, а вещества, уходящие в состояние восстановителей, повышают степень окисления.
