Окислительно-восстановительные способности атомов металлов – это важное понятие в химии, которое описывает способность металла переходить из одной степени окисления в другую. Они определяют, насколько легко атом металла может отдать или принять электроны в химических реакциях. Эти способности играют ключевую роль в различных химических процессах и имеют важное практическое применение в различных областях науки и промышленности.
Основные принципы окислительно-восстановительных способностей атомов металлов основаны на их электронной структуре. Переход от одной степени окисления к другой происходит путем обмена электронами. Металлы имеют низкую электроотрицательность и малую энергию ионизации, что делает их хорошими восстановителями, т.е. имеющими способность отдавать электроны. При этом, чем меньше энергия ионизации металла, тем легче он отдает электроны и тем выше его окислительная способность.
Роль окислительно-восстановительных способностей атомов металлов в химических реакциях нельзя недооценивать. Окислительный и восстановительный потенциал металла может определять направление и скорость реакции. Металлы с высокой окислительной способностью могут легко окислять другие вещества, в то время как металлы с высокой восстановительной способностью могут легко восстанавливаться другими веществами.
Роль металлов в химических реакциях

Металлы играют ключевую роль во множестве химических реакций благодаря их уникальным окислительно-восстановительным свойствам. Окислительно-восстановительные реакции с участием металлов осуществляются благодаря способности металлов к донорству электронов.
Атомы металлов обычно имеют низкую электроотрицательность, что означает, что они имеют большую тенденцию отдавать электроны во время реакции. Это делает металлы хорошими окислителями, так как они способны окислять вещества, получая электроны от других реагентов.
В результате металлы могут участвовать в реакциях окисления-восстановления, при которых одна часть реагента окисляется, а другая часть восстанавливается. Например, металл может окислиться, отдавая электроны другому веществу, которое в результате восстанавливается.
Реакции с участием металлов имеют широкое применение в различных областях, включая электрохимию, синтез органических соединений и производство металлов. Например, металлы используются в батареях, где они служат в качестве окислителей или восстановителей, и в катализе, где металлические катализаторы ускоряют химические реакции.
Кроме того, металлы могут играть роль катализаторов в реакциях, где они участвуют, но не изменяются химически. Например, металлические катализаторы используются в процессе гидрогенирования, где они ускоряют реакцию восстановления олефинов в алкены.
Таким образом, роль металлов в химических реакциях связана с их способностью окисляться и восстанавливаться, что позволяет им участвовать в окислительно-восстановительных реакциях и выполнять различные функции, как в процессах синтеза, так и в промышленности.
Металлы как окислители
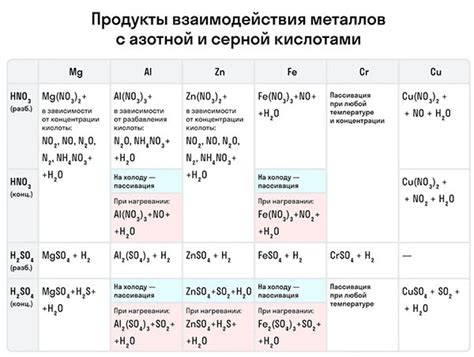
Металлы обладают высокой химической активностью и широко используются как окислители в химических реакциях. Они способны отдавать один или несколько электронов в химической реакции, что позволяет им проявлять свои окислительные свойства.
Окислительно-восстановительные реакции, в которых металлы выступают в роли окислителей, часто происходят с участием кислорода или других электроотрицательных элементов. Металлы отдают электроны электроотрицательным элементам, при этом сами окисляются и образуют положительные ионы.
При окислении металлы образуют ионы, которые часто обладают положительным зарядом. Например, окисление железа приводит к образованию иона железа Fe3+, а окисление цинка - к образованию иона цинка Zn2+. Эти ионы свободно перемещаются в растворах и участвуют в различных химических реакциях.
Роль металлов-окислителей в химических реакциях может быть весьма разнообразной. Однако, в большинстве случаев, металлы отдают электроны и переходят в более высокую степень окисления. Это позволяет им стать ионами, которые могут образовывать разнообразные соединения и участвовать в дальнейших химических реакциях.
Металлы как восстановители

Металлы обладают значительной способностью к окислительно-восстановительным реакциям и могут выступать в роли восстановителей. В основе этой способности лежит возможность атомов металлов отдавать электроны, образуя положительно заряженные ионы, которые позволяют протекать окислительно-восстановительные реакции.
Металлические атомы отдают электроны другим элементам, образуя положительно заряженные ионы металла и отрицательно заряженные ионы другого элемента. Это происходит в химических реакциях, где металл выступает как восстановитель. Электроны, переданные атомами металла, позволяют другому элементу получить дополнительные электроны и приобрести отрицательный заряд.
Металлическая активность определяет способность атомов металла отдавать электроны. Металлы с большей активностью будут легче отдавать электроны и выступать в роли восстановителей. Например, щелочные металлы, такие как натрий и калий, обладают высокой активностью и могут отдавать электроны с легкостью.
Металлы как восстановители активно применяются в различных областях, включая промышленность, электрохимию, металлургию и многое другое. Они играют важную роль в таких процессах, как производство металлических изделий, гальваническое покрытие, электролиз, аккумуляторные батареи и т.д.
Окислительно-восстановительные способности металлов

Окислительно-восстановительные способности металлов являются одной из основных характеристик данных элементов и являются ключевыми во многих химических реакциях. Металлы обладают способностью переходить от одного окислительного состояния к другому, что позволяет им взаимодействовать с другими веществами и принимать участие в различных процессах.
Окислительные свойства металлов проявляются в их способности отдавать электроны, тем самым образуя положительно заряженные ионы, или катионы. При этом они сами претерпевают окисление и переходят в более высокое окислительное состояние. Примером такого взаимодействия металла с окислителем может служить реакция железа с кислородом, при которой железо окисляется и образует окись железа.
Восстановительные свойства металлов проявляются в их способности принимать электроны от окислителей. В результате эти металлы претерпевают восстановление и переходят в более низкое окислительное состояние. Например, алюминий может взаимодействовать с хлором, при этом алюминий восстанавливается до нулевого окислительного состояния, а хлор образует хлорид алюминия.
Окислительно-восстановительные свойства металлов имеют важное значение не только в химических реакциях, но и в различных технологических процессах. Например, они применяются в гальванических элементах, электролитических процессах, катализаторах и других важных областях. Понимание этих свойств позволяет управлять реакциями, контролировать поток электронов и получать нужные продукты в химических и электрохимических процессах.
Формирование ионосферы
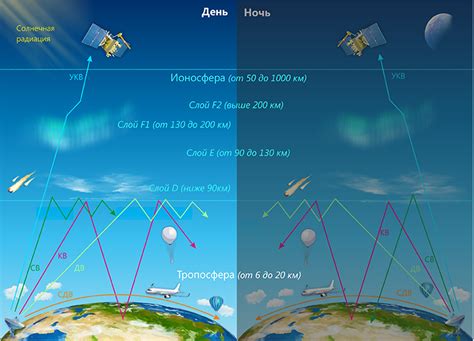
Ионосфера — это верхний слой атмосферы, населенный ионами и свободными электронами. Ионосфера играет важную роль во многих процессах, происходящих в атмосфере и в космическом пространстве.
Формирование ионосферы происходит благодаря взаимодействию высокоэнергетических солнечных частиц с атомами и молекулами в верхних слоях атмосферы. Солнечные частицы, попадая в атмосферу, вырывают электроны из атомов и молекул, образуя ионы и свободные электроны.
В ионосфере обнаруживается значительное количество ионов различных элементов, включая металлы, такие как натрий, калий, кальций и другие. Атомы этих металлов могут дать несколько электронов и образовать положительно заряженные ионы.
Формирование ионов металлов в ионосфере имеет важное значение для понимания химических и физических процессов, происходящих в этом слое атмосферы и оказывающих влияние на радио и земные коммуникации. Ионы металлов могут быть использованы для измерения плотности и температуры ионосферы, а также для изучения движения ионосферных ветров и взаимодействия с космическими объектами.
Коррозия и защитные покрытия
Коррозия – это нежелательный процесс, при котором металлические материалы подвергаются разрушению под воздействием окружающей среды. Она является проблемой для многих отраслей промышленности, таких как строительство, автомобильная и аэрокосмическая промышленность, энергетика и даже бытовая сфера.
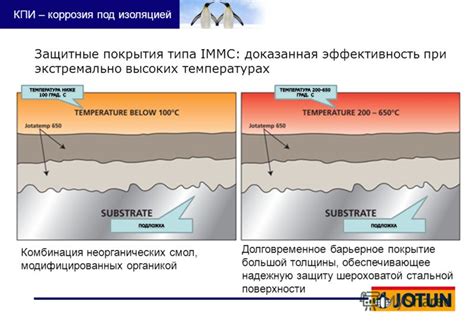
Одним из способов защиты от коррозии является нанесение защитных покрытий на поверхность металла. Защитные покрытия предназначены для создания барьера между металлом и окружающей средой, предотвращая воздействие агрессивных элементов, таких как влага, кислород, химически активные вещества.
Наиболее распространенными и эффективными материалами для защитных покрытий на металлических поверхностях являются краски и лаки. Они создают защитное покрытие, препятствующее проникновению влаги и кислорода. Кроме того, некоторые краски добавляют специальные антикоррозийные добавки, улучшающие стойкость покрытия к воздействию агрессивных факторов.
Другими методами защиты от коррозии являются электрохимические покрытия, такие как гальванические покрытия и анодное оксидирование. Гальваническое покрытие основано на электролитическом осаждении покрытия на поверхность металла, обеспечивая ему защиту от окружающей среды. Анодное оксидирование, с другой стороны, производит покрытие оксида на поверхности металла, улучшая его стойкость к коррозии.
Важно отметить, что выбор конкретного защитного покрытия зависит от типа металла и условий его эксплуатации. Некоторые металлы, такие как алюминий и цинк, имеют встроенные защитные свойства и могут образовывать пассивные слои оксидов на своей поверхности. Однако, в большинстве случаев требуется дополнительная защита для предотвращения коррозии и продления срока службы металлических конструкций и изделий.
Электролиз и электрохимические процессы
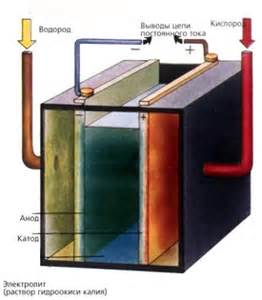
Электролиз является важным процессом в электрохимии, который позволяет превращать электрическую энергию в химическую. Он проводится путем применения постоянного электрического тока к электролиту, содержащему ионы. В результате электролиза происходят окислительно-восстановительные реакции, в которых ионы переходят в атомы или молекулы, анализируются или синтезируются различные вещества.
Электролиз имеет широкий спектр применений и играет важную роль в различных отраслях науки и промышленности. Например, он используется для получения металлов из их соединений, обработки поверхностей металлов, производства химических соединений и элементов, а также в электрохимических исследованиях.
В процессе электролиза важную роль играют атомы металлов и их окислительно-восстановительные способности. Металлы имеют различные степени электроотрицательности, что определяет их способность быть окислителями или восстановителями. Например, металлы с меньшей электроотрицательностью обладают большей способностью к окислению, а металлы с большей электроотрицательностью - к восстановлению.
Окислительно-восстановительные реакции, происходящие в процессе электролиза, могут быть представлены в виде электродных потенциалов металлов. Электродный потенциал - это мера способности металла принимать или отдавать электроны. Чем больше разница электродных потенциалов между металлами, тем более интенсивными будут процессы окисления и восстановления.
Участие в реакциях переноса электрона

Атомы металлов активно участвуют в реакциях переноса электрона, которые являются одним из основных типов химических реакций. Эти реакции происходят в результате взаимодействия металла с другими веществами, включая оксиды, кислоты и соли.
В реакциях переноса электрона атом металла переходит из одного окислительного состояния в другое, передавая электроны другому веществу. Это позволяет металлам выполнять различные функции в химических реакциях, такие как окисление, восстановление и каталитическая активность.
Окислительно-восстановительные реакции с участием металлов имеют широкую практическую значимость. Например, они используются в электрохимических процессах, таких как производство металлов, аккумуляторов и электролиза. Также эти реакции играют важную роль в биохимических процессах, таких как дыхание и фотосинтез, где металлы выполняют функции ферментов и кофакторов.
Участие металлов в реакциях переноса электрона обусловлено их особыми электронными свойствами. Атомы металлов имеют относительно низкую электроотрицательность и способны легко отдавать или принимать электроны. Большинство металлов имеют малое количество электронов во внешней электронной оболочке, что облегчает процесс переноса электрона.
Вопрос-ответ

Какие металлы обладают высокой окислительно-восстановительной способностью?
Высокую окислительно-восстановительную способность часто проявляют металлы из группы активных металлов, такие как натрий (Na), калий (K), литий (Li) и другие. Они легко окисляются, теряя электроны, и могут восстанавливаться, получая электроны.
Как окисление и восстановление атомов металлов связаны с химическими реакциями?
Окислительно-восстановительные реакции являются основой большинства химических реакций. В таких реакциях атомы металлов могут участвовать в процессах окисления и восстановления. При окислении атом металла теряет электроны, а при восстановлении - получает их. Это изменение числа электронов в атоме металла позволяет осуществить превращение одних веществ в другие.
Каковы основные принципы окислительно-восстановительных реакций?
Основным принципом окислительно-восстановительных реакций является передача электронов между веществами. Окислитель - это вещество, способное принять электроны, тем самым окисляя другое вещество, которое отдает электроны и восстанавливается. Важно отметить, что при окислении одного вещества всегда происходит восстановление другого.
Какой роль играют металлы с высокой окислительно-восстановительной способностью в химических реакциях?
Металлы с высокой окислительно-восстановительной способностью играют важную роль в химических реакциях. Они могут служить как окислителями, способными отбирать электроны у других веществ и окислять их, так и восстановителями, способными отдавать электроны и восстанавливать оксиды других веществ. Благодаря этим свойствам металлы могут участвовать в множестве химических процессов и реакций.
